da responsabilidade exclusiva dos seus autores.

























-
Pneumologista
Serviço de Pneumologia do Centro Hospitalar e Universitário de Coimbra

PF-ILD significa Progressive Fibrosing Interstitial Lung Disease, ou em Português, DPI-FP, doença pulmonar intersticial fibrosante e progressiva.
O grupo das doenças pulmonares intersticiais (DPI) é extenso e heterogéneo, não existindo ainda uma classificação globalmente consensual das mesmas. Uma possibilidade é classificá-las em doenças de causa desconhecida, doenças de causa conhecida (autoimune sistémica ou exposição), granu-lomatoses e entidades raras. Cada uma das doenças específicas pode ser enquadrada num destes grupos.1 Na figura 1 pode encontrar-se uma proposta de classificação para as doenças mais comuns.
Figura 1: Proposta de classificação das doenças intersticiais mais comuns. São usadas as siglas habituais. DTC: doenças do tecido conjuntivo; PH: pneumonite de hipersensibilidade; PII: pneumonias intersticiais idiopáticas; LAM: linfangioleiomiomatose; PLCH: histiocitose pulmonar de células de Langerhans; FPI: fibrose pulmonar idiopática; NSIP: pneumonia intersticial não específica; RB-ILD: bronquiolite respiratória com doença pulmonar intersticial; DIP: pneumonia intersticial descamativa; COP: pneumonia em organização criptogénica; AIP: pneumonia intersticial aguda; LIP: pneumonia intersticial linfocítica; PPFE: fibroelastose pleuroparenquimatosa.
Um dos aspetos mais característicos das DPI é a importante variabilidade do seu comportamento evolutivo, com ou sem tratamento. Algumas destas doenças são exclusivamente inflamatórias, mas a maioria pode cursar com fibrose pulmonar, definida como uma desorganização arquitetural irreversível do parênquima pulmonar. Quando o processo de fibrose ocorre e progride apesar do tratamento adequado, podemos classificá-la como doença fibrosante progressiva. O con-ceito deriva de uma classificação alternativa das doenças de acordo com o seu comportamento clínico, inicialmente proposta por Athol Wells em 2003 e integrada na classificação das pneumonias intersticiais idiopáticas em 2013.2 Esta classificação do comportamento é utilizada para eleger a melhor estratégia de monitorização e tratamento de uma forma quase independente do diagnóstico específico. Na tabela 1, podemos encontrar a classificação de comportamento de doença publicada na classificação internacional das pneumonias intersticiais idiopáticas de 2013.
Tabela 1: Classificação de comportamento de doença, adaptado de Travis WD, et al.2
A DPI-FP corresponde à forma 5, progressão inexorável independentemente da terapêutica. Esta classificação corresponde ainda a uma versão juntar (lumping) da clássica discussão entre juntar ou separar (lumping vs. splitting) as doenças intersticiais.3
Refere-se que a junção das doenças neste fenótipo não reduz a importância de um diagnóstico preciso para cada doente, uma vez que a abordagem da doença progressiva não exclui o tratamento dirigido a uma entidade. Para uma discussão detalhada, consultar o último capítulo desta obra. Importa ainda mencionar que a definição de progressão tem sido alvo de discussão com criação de critérios que permitam classificar doentes quer para efeitos de tratamento quer para inclusão em ensaios clínicos. As várias propostas são descritas na pergunta 6: como é feita a avaliação da progressão nas DPI-FP?
A doença com maior associação ao fenótipo DPI-FP é a fibrose pulmonar idiopática, uma vez que é invariavelmente fibrótica e progressiva apesar dos tratamentos disponíveis. Já nas outras entidades, a proporção de doentes com este fenótipo é variável e não totalmente conhecida. As doenças intersticiais são na sua maioria raras quando consideradas individualmente, o que dificulta a realização de estudos de grande dimensão. Um inquérito realizado a 486 Pneumologistas, Reumatologistas e Internistas que trabalhavam na Europa, Japão ou EUA apontou para uma taxa de 18 a 32% de fenótipo DPI-FP na globalidade das doenças intersticiais não FPI.4 Além da FPI, os grupos com maior probabilidade desta evolução parecem ser as doenças autoimunes como a esclerose sistémica e a artrite reumatoide, a pneumonite de hipersensibilidade e a sarcoidose. A doença inclassificável, um subgrupo de pneumonias intersticial idiopática em que o estudo não permitiu estabelecer um diagnóstico de confiança também pode apresentar esta evolução.5
Em 2020 foi ainda sugerido que os doentes com síndrome da dificuldade respiratória do adulto (ARDS) secundária a infeção por SARS-CoV-2 podem evoluir para doença fibrótica, eventualmente progressiva. Esta possibilidade é ancorada em observações prévias de fibrose progressiva no seguimento de outras causas de ARDS. A mesma ganha especial relevância atendendo ao número muito elevado de doentes com ARDS por COVID-19 já registados a nível global, o que significa que mesmo que apenas uma pequena proporção de doentes evolua desta forma, os números absolutos podem tornar-se significativos. Em novembro de 2020, já existem vários estudos observacionais em curso, assim como ensaios clínicos com uso de nintedanib e pirfenidona em doentes com fibrose pulmonar após ARDS a COVID-19.6
As doenças intersticiais caracterizam-se por uma elevada heterogeneidade clínica, o que também é observado na sua fisiopatologia. Notavelmente, algumas têm um substrato fibrosante, sem inflamação desde a sua incepção, enquanto outras parecem iniciar-se como um processo inflamatório que pode depois evoluir para fibrose. No entanto, as doenças que evoluem para fibrose partilham algumas vias de progressão, passando por um insulto crónico epitelial e vascular que leva à destruição celular, seguidos de reparação anormal e desregulada. Os fibroblastos são uma célula central nestes mecanismos de reparação ineficaz. São recrutados de outros locais ou proliferam localmente nos locais da lesão, onde são ativados e evoluem para miofibroblastos que produzem matriz extracelular. Associa-se ainda redução da degradação desta matriz levando a um excesso de colagénio e fibrose.
O mecanismo de lesão passa pelo recrutamento e ativação de linfócitos e macrófagos com produção de citocinas fibrogénicas. As mais relevantes são o TGF-ß, o PDGF e as vias WNT e hedgehog. Uma característica muito importante da fibrogénese é que a mesma se torna autossustentada, culminando num círculo vicioso em que a própria fibrose promove mais fibrose numa progressão inexorável.7 Funcionalmente, ocorre tipicamente uma síndrome restritiva com redução da capacidade de difusão. A restrição resulta de uma perda de compliance pulmonar causada pelo excesso de colagénio tecidular. A redução da capacidade de difusão tem várias causas, sendo as principais o espessamento da barreira alveolocapilar e a redução da área de trocas secundária à obliteração de capilares.8 Uma das complicações mais graves da doença é o desenvolvimento de hipertensão pulmonar. A fisiopatologia da hipertensão pulmonar em doentes com fibrose pulmonar é complexa e não totalmente conhecida. Em alguns casos, a hipoxemia crónica e a vasoconstrição hipóxica parecem ter um papel fundamental, enquanto em outros, os mecanismos se assemelham mais aos da hipertensão pulmonar idiopática. Em ambas as situações, o tratamento tem uma eficácia limitada e prognóstico é sombrio.9
A abordagem ao doente com patologia pulmonar intersticial compreende também a avaliação do seu prognóstico, o qual é significativamente pior na presença de fibrose progressiva. Os estudos observacionais têm descrito vários fatores que são mais frequentes nas populações com fenótipo fibrosante progressivo, sendo alguns comuns à generalidade das entidades e outros dependentes da doença subjacente. Os fatores de risco independentes do diagnóstico incluem o padrão radiológico UIP, sinais extensos de fibrose na TC com bronquiectasias extensas, idade avançada, demonstração de progressão rápida, má resposta à terapêutica inicial e algumas alterações genéticas, como as telomeropatias e os polimorfismos do gene MUC5B, A que codifica uma mucina.
Nos doentes com esclerose sistémica, a fibrose pulmonar progressiva ocorre mais frequentemente em homens de idade mais avançada à data do diagnóstico, em doentes com diagnóstico mais recente (há menos de 7 anos), forma difusa da doença, anticorpos anti-Scl-70, refluxo gastrointestinal e doença mais extensa na TCAR. A artrite reumatoide evolui com fibrose pulmonar progressiva em doentes do sexo masculino, idade mais avançada, história de tabagismo, padrão UIP ou doença mais extensa na TCAR e no estudo funcional respiratório. Nos doentes com pneumonite de hipersensibilidade, os fatores de risco incluem idade avançada, histórico de tabagismo e padrão UIP, mas o fator mais importante é a não identificação do antigénio causal. A sarcoidose tende a progredir com fibrose em mulheres, pessoas de raça negra e em doentes com envolvimento superior a 20% na TC.10
A fibrose pulmonar idiopática é a doença fibrosante progressiva mais frequente e cuja história natural é mais bem conhecida. Caracteriza-se por mau prognóstico quando não tratada, com uma sobrevivência mediana de 3 anos após o diagnóstico. A evolução típica inclui a perda progressiva da função, resultando em dispneia, incapacidade e mortalidade precoce. Apesar de esta ser a progressão mais típica, há uma variabilidade assinalável, sendo a mesma imprevisível para um doente específico. A progressão ocorre com maior rapidez em alguns doentes (rapid progressors) enquanto em outros se observa relativa estabilidade ao longo dos anos (slow progressors). Qualquer um destes percursos pode ser interrompido por exacerbações, que são períodos de agravamento súbito que levam à morte em até 50% dos casos e aceleram a progressão da doença nos sobreviventes. Os estudos das novas terapêuticas em doentes com FPI têm utilizado a perda da capacidade vital forçada (FVC) como marcador do risco de progressão e morte. De uma forma geral, os antifibróticos reduzem a taxa de perda de função para metade. O estudo PANTHER em 2011 revelou ainda que a imunossupressão com corticoide e azatioprina agrava esta progressão e aumenta a taxa de internamentos e a mortalidade.11
Os estudos nas outras doenças intersticiais têm demonstrado a existência de um fenótipo comum que ocorre numa proporção variável dos afetados. Nesta população, a progressão parece ser inexorável, com perda progressiva de função, degradação da qualidade de vida e rápida evolução para incapacidade e morte apesar da terapêutica julgada mais adequada. Uma análise do braço placebo dos estudos INBUILD (doentes com DPI-FP não-FPI) e INPULSIS (doentes com FPI) revelou que os doentes com DPI-FP apresentam a mesma evolução média em termos de perda de FVC que os doentes com FPI. Esta progressão foi independente do diagnóstico específico e corresponde a cerca de 200 mL/ano.
Na análise por subgrupos, observou-se que os doentes DPI-FP com padrão UIP também apresentaram uma progressão similar aos doentes com FPI, mas aqueles com outros padrões radiológicos pareceram ter uma evolução mais lenta, com perda de cerca de 160 mL/ano de FVC. A análise da mortalidade revelou as mesmas semelhanças entre a população geral dos estudos INBUILD e INPULSIS, com menor mortalidade nos doentes com um padrão radiológico não UIP. Existem dados mais detalhados relativos à mortalidade, mas são provenientes de estudos menores. Apontam para sobrevivências diferentes de acordo com o diagnóstico.
Na doença inclassificável, a sobrevivência média aos 5 anos varia entre os 45% e os 70%. Nas doenças autoimunes, foi encontrada uma sobrevivência mediana de 3 anos em doentes com artrite reumatoide e padrão UIP. Nos doentes com esclerose sistémica e doença intersticial, a sobrevivência mediana foi de 40% aos 10 anos. A sarcoidose com fenótipo DPI-FP é menos frequente sendo a sobrevivência descrita de 90% aos 10 anos.12
Tal como é referido no nome, o diagnóstico de DPI-FP é realizado quando há demonstração de existência de fibrose pulmonar e da sua natureza progressiva, apesar do tratamento adequado. A existência de fibrose pulmonar é geralmente fácil de avaliar através da TCAR, incluindo uma avaliação subjetiva da sua extensão, mas a avaliação da progressão é mais complexa e pode ser indesejavelmente demorada.
Não há ainda uma forma consensual de demonstrar progressão na doença fibrótica. Os clínicos recorrem habitualmente a uma conjugação de vários fatores num doente específico. Os parâmetros considerados incluem as queixas, imagiologia, função respiratória em repouso e a capacidade de exercício. Já os ensaios clínicos sobre terapêutica têm utilizado diferentes critérios para a seleção dos indivíduos incluídos, o que dificulta a comparação dos resultados e a criação de recomendações para diagnóstico e terapêutica. O estudo com mais impacto até ao momento é o INBUILD, que testou nintedanib em doentes com DPI-FP não-FPI que apresentavam um de três critérios de inclusão ao longo de dois anos: perda relativa de 10% ou mais de capacidade vital forçada ou a associação de dois dos seguintes parâmetros: perda relativa de 5% FVC ou mais, agravamento imagiológico, agravamento clínico.
Outros estudos como o RELIEF que testou pirfenidona em DPI-FP não-FPI incluiu doentes com perda absoluta de 5% ou mais de FVC ao longo de um ano.13 O estudo INBUILD, que testou pirfenidona em doença inclassificável fibrótica e progressiva, incluiu aqueles que apresentavam uma perda absoluta de 5% ou mais na FVC ao longo de 6 meses ou agravamento dos sintomas.14 Em termos de identificação de fibrose, os estudos foram mais homogéneos e passaram pela necessidade de presença em fibrose em mais do que 10% do campo pulmonar. Um estudo recente comparou 3 conjuntos de critérios numa população de 587 doentes com doença fibrótica e encontrou diferenças significativas entre os vários critérios, demonstrando que os mesmos não são equivalentes e reforçando a importância da criação de consensos nesta área.15
Os biomarcadores são a base da medicina de precisão, permitindo identificar subgrupos de doentes com características comuns, como o prognóstico ou a resposta ao tratamento. Um biomarcador para ser considerado como tal deve ainda ter um impacto na orientação clínica, como no diagnóstico, avaliação do prognóstico ou tratamento.16
No caso específico da DPI-FP, é reconhecido que o diagnóstico se associa quase sempre a um atraso, pois é necessário que se observe progressão para confirmar o mesmo. Assim, torna-se especialmente importante identificar biomarcadores que possam prever a progressão antes desta ocorrer. O biomarcador mais promissor nesta identificação é a proteína Krebs von den Lungen-6 (KL-6). A medicação do KL-6 está disponível comercialmente e é amplamente utilizada no Japão. Alguns estudos em curso centram-se na associação deste marcador com scores clínicos já validados, como o score GAP (gender age physiology). O estudo Its Not JUST Idiopathic pulmonary fibrosis Study (INJUSTIS), também em curso, pretende estudar quatro biomarcadores epiteliais, metaloproteinase 7 da matriz (MMP-7), antigénio do cancro-125 (CA-125), antigénio carbohidrato 19-9 (CA19-9) e proteína do surfactante D (SP-D) em paralelo a três marcadores de renovação da matriz, proteína C reativa degradada pelo MMP-1/8 (CRPM), colagénio 3 degradado pela MMP-9 (C3M) e colagénio degradado pela MMP-2/9 (C6M). Vão ainda ser estudados os genótipos da mucina 5B (MUC5B), da desmoplaquina (DSP) e da proteína de ancoragem da aquinase 13 (AKAP13).
Estas classes de biomarcadores são as mais promissoras para a identificação dos doentes com este fenótipo antes de ocorrer progressão significativa.17Além do diagnóstico, será particularmente útil o desenvolvimento de biomarcadores de resposta ao tratamento, uma vez que esta avaliação pode ser difícil e demorada. Apesar da eficácia do nintedanib na redução da progressão da DPI-FP ter sido demonstrada por um ensaio clínico de qualidade, a resposta de cada doente é variável. O desenvolvimento de um biomarcador de resposta poderia não só permitir selecionar os doentes para cada tratamento como uma avaliação mais precoce da sua eficácia.
O tratamento da DPI-FP é dependente do diagnóstico subjacente e deve incluir tanto medidas farmacológicas como não farmacológicas. A abordagem deve incluir sempre que possível a identificação e eliminação da exposição à causa da doença, especialmente na pneumonite de hipersensibilidade. Da mesma forma, o tabagismo deve ser abordado e a cessação tabágica implementada, tal como a vacinação antigripal e pneumocócica.
Em termos de medicação, o nintedanib foi aprovado pela FDA e pela EMA na FPI, na doença intersticial associada à esclerose sistémica e na DPI-FP, uma vez que reduz a progressão da doença.18-20 A pirfenidona foi aprovada na FPI pela EMA e FDA.21 A pirfenidona reduziu a progressão num ensaio clínico em doentes com doença inclassificável progressiva e mais de 10% de área de fibrose na TCAR. Apesar do endpoint primário deste ensaio não ter sido avaliável, os objetivos secundários permitem suportar a eficácia nesta população.14 Os corticoides ou outros imunossupressores são habitualmente prescritos quando há suspeita de substrato inflamatório, mas a evidência é escassa, exceto na sarcoidose e na esclerose sistémica. A escolha dos imunossupressores nas outras entidades é baseada em estudos de coorte e em recomendações de especialistas. As escolhas mais habituais para cada uns dos grupos de doentes podem ser encontradas na tabela 2.22
Nos doentes com limitação funcional, a reabilitação pulmonar tem bons resultados. Quando há hipoxemia de esforço ou em repouso pode ser prescrita oxigenoterapia. As comorbidades são frequentes e devem ser identificadas e tratadas. Nos casos mais graves e quando não há contraindicações, o doente deve ser precocemente referenciado para avaliação pré-transplante pulmonar. A terapêutica paliativa é um adjunto muito importante nos doentes com formas avançadas e pode ser instituída em paralelo com todas as estratégias já referidas.22
Tabela 2: Terapia imunossupressora e antifibrótica para as doenças intersticiais que podem decorrer com fenótipo DPI-FP. Adaptado de Wijsenbeek M, et al.22 MMF: micofenolato de mofetil.
Os doentes com FPI apresentam frequentemente exacerbações agudas, às quais se associam a insuficiência respiratória grave, internamento e mortalidade significativa. As doenças fibrosantes não FPI também se associam a esse risco, embora a incidência, fatores de risco e características destes episódios sejam menos conhecidas. Uma revisão em 2018 definiu exacerbação aguda de DPI-FP como um evento agudo de deterioração clínica significativa, tipicamente com menos de um mês de evolução e que associa infiltrados de novo em vidro despolido num fundo de fibrose pulmonar. Tal como nas exacerbações de FPI, devem ser excluídas causas extraparenquimatosas do agravamento clínico, como pneumotórax, derrame pleural, insuficiência cardíaca e tromboembolia pulmonar.23 Os fatores fisiopatológicos envolvidos incluem lesão epitelial, alterações da coagulação e autoimunidade. A frequência poderá ser diferente de acordo com a doença subjacente, mas num estudo DELPHI recentemente publicado, estimou-se que a proporção de doentes com DPI-FP e, pelo menos, uma exacerbação no ano anterior, era o triplo daquela nos doentes com doença intersticial não DPI-FP.24
O tratamento das exacerbações é um desafio e existe pouca evidência disponível sobre a sua indicação. É fundamental identificar possíveis exposições como causa do agravamento, particularmente na pneumonite de hipersensibilidade. É normalmente iniciada antibioterapia de largo espetro, a qual pode ser associada a antivírico, quando em período epidémico de influenza. Os corticoides parecem trazer benefícios em algumas doenças, especialmente na sarcoidose, doenças idiopáticas, pneumonite de hipersensibilidade e doenças autoimunes. Salienta-se a necessidade de cautela no uso de corticoterapia nos doentes com esclerose sistémica progressiva atendendo ao risco de crise renal. Podem ainda ser utilizados imunossupressores em associação aos corticoides, embora a evidência seja limitada. Apesar da terapêutica, continua a observar-se uma mortalidade muito significativa no período durante e após a exacerbação.23 Neste sentido, a prevenção destes episódios torna-se fundamental. A utilização de antifibróticos reduz o risco de exacerbações em doentes com FPI. No estudo INBUILD, o nintedanib associou-se a uma redução percentual dos doentes com exacerbação ou morte ao longo do estudo, embora sem atingir o limiar de significância estatística (HR 0,68; IC a 95%: 0,46 a 1,01).18
As doenças pulmonares intersticiais associam-se a comorbidades que contribuem para a gravidade global e para a mortalidade. As associações mais frequentes à FPI são o enfisema pulmonar, doença coronária, gastrointestinal e a ansiedade e depressão. Por outro lado, a fibrose progressiva pode ainda ocorrer de forma secundária a agentes inalados ou a doença sistémica autoimune. Assim, é possível que esta população apresente uma taxa de comorbidades e complicações até superior à da população com FPI. Existem poucos estudos dirigidos à DPI-FP, mas um deles utilizou a metodologia DELPHI e reportou associação com as infeções pulmonares (29,3% dos casos), refluxo gastroesofágico (29,2%), depressão (27,2%), osteoporose (20,3%), e hipertensão pulmonar (19,8%).24 A associação entre o refluxo gastroesofágico (RGE) e a FPI já foi alvo de vários estudos.
O RGE é mais frequentemente identificado nos doentes mais graves, sendo possível que a inalação do refluído possa agravar a fibrose pulmonar. Por outro lado, a existência de fibrose com perda da compliance pulmonar também pode contribuir para agravar os episódios de refluxo. Embora não existam ensaios clínicos, uma análise dos doentes no braço placebo dos ensaios clínicos de pirfenidona em doentes FPI não mostrou um efeito benéfico da toma de inibidores da bomba de portões (IBP). O mesmo estudo sugeriu que a toma de IBP nos doentes mais graves pode aumentar o risco de infeções.25 Os autores concluem que é necessário a realização de um ensaio, o que provavelmente também se aplica aos doentes com DPI-FP não-FPI. Em conclusão, os doentes com DPI-FP parecem ter uma prevalência importante de comorbidades de vários órgãos e sistemas, sendo consensual que a sua identificação e tratamento adequado são importantes para obter os melhores resultados nesta população.
1. Cottin V, Valenzuela C. Diagnostic approach of fibrosing interstitial lung diseases of unknown origin. Presse Med 2020; 49: 2, 104021.
2. Travis WD, Costabel U, Hansell DM, et al. An official American Thoracic Society/European Respiratory Society statement: Update of the international multidisciplinary classification of the idiopathic interstitial pneumonias. Am J Respir Crit Care Med 2013; 188: 6, 733-48.
3. Wells AU, Brown KK, Flaherty KR, et al. What's in a name? That which we call IPF, by any other name would act the same. Eur Respir J 2018; 51: 5.
4. Wijsenbeek M, Kreuter M, Olson A, et al. Progressive fibrosing interstitial lung diseases: current practice in diagnosis and management. Curr Med Res Opin 2019; 35: 11, 2015-24.
5. Cottin V, Wells A. Unclassified or unclassifiable interstitial lung disease: confusing or helpful disease category? Eur Respir J 2013; 42: 3, 576-9.
6. George PM, Wells AU, Jenkins RG. Pulmonary fibrosis and COVID-19: the potential role for antifibrotic therapy. Lancet Respir Med 2020; 8: 8, 807-15.
7. Wollin L, Distler JHW, Redente EF, et al. Potential of nintedanib in treatment of progressive fibrosing interstitial lung diseases. Eur Respir J 2019; 54: 3.
8. Berend N. Respiratory disease and respiratory physiology: putting lung function into perspective interstitial lung disease. Respirology 2014; 19: 7, 952-9.
9. Pitsiou G, Papakosta D, Bouros D. Pulmonary hypertension in idiopathic pulmonary fibrosis: a review. Respiration 2011; 82: 3, 294-304.
10. Kolb M, Vasakova M. The natural history of progressive fibrosing interstitial lung diseases. Respir Res 2019; 20: 1, 57.
11. Raghu G, Rochwerg B, Zhang Y, et al. An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline: Treatment of Idiopathic Pulmonary Fibrosis. An Update of the 2011 Clinical Practice Guideline. Am J Respir Crit Care Med 2015; 192: 2, e3-19.
12. Brown KK, Martinez FJ, Walsh SLF, et al. The natural history of progressive fibrosing interstitial lung diseases. Eur Respir J 2020; 55: 6.
13. Behr J, Neuser P, Prasse A, et al. Exploring efficacy and safety of oral Pirfenidone for progressive, non-IPF lung fibrosis (RELIEF) - a randomized, double-blind, placebo-controlled, parallel group, multi-center, phase II trial. BMC Pulm Med 2017; 17: 1, 122.
14. Maher TM, Corte TJ, Fischer A, et al. Pirfenidone in patients with unclassifiable progressive fibrosing interstitial lung disease: a double-blind, randomised, placebo-controlled, phase 2 trial. Lancet Respir Med 2020; 8: 2, 147-57.
15. Wong AW, Ryerson CJ, Guler SA. Progression of fibrosing interstitial lung disease. Respir Res 2020; 21: 1, 32.
16. Alfaro TM, Robalo Cordeiro C. Comorbidity in idiopathic pulmonary fibrosis - what can biomarkers tell us? Ther Adv Respir Dis 2020; 14, 1753466620910092.
17. Khan F, Stewart I, Howard L, et al. The Its Not JUST Idiopathic pulmonary fibrosis Study (INJUSTIS): description of the protocol for a multicentre prospective observational cohort study identifying biomarkers of progressive fibrotic lung disease. BMJ Open Respir Res 2019; 6: 1, e000439.
18. Flaherty KR, Wells AU, Cottin V, et al. Nintedanib in Progressive Fibrosing Interstitial Lung Diseases. N Engl J Med 2019; 381: 18, 1718-27.
19. Distler O, Highland KB, Gahlemann M, et al. Nintedanib for Systemic Sclerosis-Associated Interstitial Lung Disease. N Engl J Med 2019; 380: 26, 2518-28.
20. Richeldi L, du Bois RM, Raghu G, et al. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med 2014; 370: 22, 2071-82.
21. King TE, Jr., Bradford WZ, Castro-Bernardini S, et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med 2014; 370: 22, 2083-92.
22. Wijsenbeek M, Cottin V. Spectrum of Fibrotic Lung Diseases. N Engl J Med 2020; 383: 10, 958-68.
23. Kolb M, Bondue B, Pesci A, et al. Acute exacerbations of progressive-fibrosing interstitial lung diseases. Eur Respir Rev 2018; 27: 150.
24. Wuyts WA, Papiris S, Manali E, et al. The Burden of Progressive Fibrosing Interstitial Lung Disease: A DELPHI Approach. Adv Ther 2020; 37: 7, 3246-64.
25. Kreuter M, Wuyts W, Renzoni E, et al. Antacid therapy and disease outcomes in idiopathic pulmonary fibrosis: a pooled analysis. Lancet Respir Med 2016; 4: 5, 381-9.

-
Radiologista
Serviço de Radiologia do Centro Hospitalar Universitário de São João, EPE Porto

A radiologia desempenha um papel crucial no diagnóstico e seguimento das doenças pulmonares difusas, tendo um papel absolutamente central na abordagem diagnóstica multidisciplinar destas doenças. A tomografia computorizada de alta resolução (TCAR) do tórax é, atualmente, a técnica gold-standard para avaliação anatómica do pulmão, permitindo a obtenção de imagens altamente detalhadas de todos os seus componentes, mas sobretudo do parênquima pulmonar (do interstício) e das grandes e pequenas vias aéreas. A TCAR é provavelmente o exame subsidiário mais importante em toda a marcha diagnóstica, em alguns casos com tal especificidade que permite dispensar a realização de exames mais invasivos (biopsia cirúrgica, por exemplo).1,2 Por último, tem também um papel importante na aferição da resposta às terapêuticas instituídas através da realização de exames seriados para avaliação da evolução da doença.
A radiografia simples do tórax é, de longe, o exame mais utilizado em radiologia diagnóstica em todo o mundo. Trata-se de um exame não-invasivo, acessível, portátil e barato, com a única desvantagem de utilizar radiação ionizante. A radiografia de tórax continua a ser muitas vezes o primeiro exame indiciador da presença de uma doença pulmonar fibrosante, demonstrando na maioria do casos opacidades lineares e reticulares ou perda de volume pulmonar (ou, mais frequentemente, uma combinação destes sinais). No entanto, a sensibilidade e especificidade da radiografia convencional no diagnóstico destas doenças não é a ideal e uma radiografia normal não permite excluir a presença de uma doença pulmonar difusa quando a suspeita clínica é elevada. Os enormes avanços tecnológicos recentes na TCAR, aliados ao seu uso cada vez mais universal, relegaram a radiografia convencional do tórax para um papel secundário neste grupo de patologias.
Contudo, a radiografia torácica é, nos dias de hoje, ainda amplamente utilizada como o primeiro exame de imagem na suspeita de doença respiratória, permitindo avaliar a presença de pneumotórax, infeção, neoplasia, entre outros.
A TCAR não é mais do que uma tomografia computorizada do tórax em que as imagens são reconstruídas em secções finas (“cortes finos”, tipicamente com espessuras < 2,0 mm) e em que são utilizados algoritmos de reconstrução de alta frequência espacial. 3-5 Esta combinação permite a obtenção de imagens extremamente detalhadas do interstício pulmonar. A importância da utilização de uma técnica adequada deve ser enfatizada. O uso de reconstruções de alta resolução não-contíguas (isto é, imagens com espessura de 1 mm espaçadas entre si em 10 ou 20 mm), frequentemente utilizadas até há 10 anos atrás, não deve ser feita por rotina hoje em dia, sendo a norma o uso das reconstruções volumétricas (cortes de 1 mm espaçados de 1 mm ou até menos, com overlap). Este tipo de reconstrução permite uma visualização de todo o pulmão com elevada qualidade, aumentando a confiança diagnóstica. Reconstruções multiplanares (coronais e sagitais) devem ser realizadas por rotina. Para além das aquisições standard (em decúbito dorsal e inspiração profunda), alguns centros de radiologia com experiência em doenças pulmonares difusas efetuam como parte do seu protocolo de TCAR duas aquisições adicionais: imagens em expiração e imagens em decúbito ventral. As aquisições em expiração têm como objetivo primordial avaliar a presença de sinais de doença obstrutiva das pequenas vias aéreas; as aquisições em decúbito ventral podem ajudar a diferenciar atelectasias de decúbito de verdadeiras alterações do interstício pulmonar em fase inicial. Não é obrigatório que estas aquisições adicionais sejam obtidas de forma contígua, podendo até ser desejável, numa perspetiva de redução da dose de radiação recebida pelo doente, que se obtenham imagens não-contíguas (com intervalos de 10 mm, por exemplo), utilizando tecnologias de redução de dose sempre que possível.6
Por último, o uso de contraste iodado endovenoso é, na maioria dos casos, desnecessário na avaliação destas patologias. Em resumo, a TCAR é um método mais sensível na deteção e caraterização das doenças do interstício pulmonar e assume um papel central na abordagem multidisciplinar destas doenças, tal como explicitado nas guidelines conjuntas mais recentes para o diagnóstico de fibrose pulmonar idiopática e pneumonite de hipersensibilidade.5,6 É a integração dos achados imagiológicos em “padrões” de doença pulmonar que permite ao radiologista elaborar um diagnóstico diferencial.
O diagnóstico de uma doença pulmonar fibrosante é feito em TCAR pela presença de distorção arquitetural, de opacidades reticulares (ou “padrão reticular”), de bronquiectasias e bronquiolectasias de tração e de padrão “em favo de mel”.3 Segundo a Fleischner Society7, a distorção arquitetural carateriza-se em TCAR por uma alteração da normal anatomia do lóbulo pulmonar secundário, geralmente associada a perda de volume pulmonar. O padrão reticular carateriza-se pela presença de inúmeras pequenas linhas dentro dos limites do lóbulo pulmonar secundário (simulando a presença de uma rede, daí o termo “reticular”) e correlaciona-se histologicamente com o espessamento dos septos inter e intralobulares. Este padrão não é específico das doenças fibróticas (pode surgir no edema pulmonar ou na linfangite carcinomatosa, por exemplo), mas geralmente acompanha as outras manifestações imagiológicas de fibrose pulmonar. As bronquiectasias (e bronquiolectasias) de tração traduzem uma dilatação irreversível e irregular das pequenas vias aéreas condicionada por um processo fibrosante circundante. O padrão “em favo de mel” (honeycombing) é considerado o sinal mais específico de fibrose pulmonar em TCAR e carateriza-se por um agrupamento de espaços císticos com diâmetros semelhantes (geralmente na ordem dos 3-10 mm), tipicamente em localização sub-pleural, com paredes bem delimitadas e, na maioria das vezes, partilhadas entre si (Figura 1).
Figura 1:
Padrão “em favo de mel”. Imagem axial de tomografia computorizada de alta resolução de doente com envolvimento pulmonar por artrite reumatoide demonstra um padrão reticular de predomínio periférico com padrão “em favo de mel” subpleural nos segmentos superiores dos lobos inferiores (setas).
Este sinal correlaciona-se histologicamente com fibrose pulmonar “terminal” (independentemente da causa). O padrão “em favo de mel” é um dos sinais fundamentais no algoritmo diagnóstico de pneumonia intersticial usual/ fibrose pulmonar idiopática (UIP/FPI).3-5 Note-se, contudo, que existe uma variabilidade inter e intraobservador considerável na avaliação destes achados imagiológicos (sobretudo na avaliação do padrão “em favo de mel”8), pelo que devem ser utilizados com precaução em relatórios radiológicos, tendo em conta as suas implicações diagnósticas e prognósticas. Faz-se, por último, uma referência ao padrão em “vidro despolido”.
Este padrão define-se como um aumento da opacidade do parênquima pulmonar com preservação das marcas vasculares e brônquicas subjacentes.7 Qualquer processo patológico que resulte na diminuição da quantidade de ar intra-alveolar (seja por preenchimento alveolar seja por espessa-mento do interstício pulmonar) traduz-se por opacidades em “vidro despolido” na TCAR. Este sinal acompanha muitas das doenças pulmonares fibrosantes difusas e, quando extenso, é importante no diagnóstico diferencial.3
São várias as doenças do interstício pulmonar que podem cursar com um fenótipo progressivo, destacando-se, pela sua frequência, as pneumonias intersticiais idiopáticas, as doenças autoimunes com envolvimento pulmonar, a pneumonite de hipersensibilidade, a sarcoidose e as doenças ocupacionais ou pneumoconioses2
Segundo a classificação conjunta da American Thoracic Society/European Respiratory Society (ATS/ERS)9, as pneumonias intersticiais idiopáticas que mais frequentemente tomam este curso clínico são a FPI e a pneumonia intersticial não-específica idiopática (iNSIP) - também chamadas de pneumonias intersticiais fibrosantes crónicas. O radiologista tem um papel fundamental no diagnóstico destas entidades em sede de reunião multidisciplinar. A caraterística fundamental da FPI é a presença de um padrão imagiológico ou histológico de UIP.3-5,9-11 Em TCAR, o padrão de UIP carateriza-se pela presença de um padrão reticular subpleural, de predomínio basal (inferior), com padrão “em favo de mel” e bronquiectasias ou bronquiolectasias de tração (Figura 2).3-5,12
Figura 2: Padrão de pneumonia intersticial usual típica na fibrose pulmonar idiopática. Imagens de tomografia computorizada de alta resolução demonstram perda de volume, distorção arquitetural e um padrão reticular periférico com bronquiectasias de tração e um extenso padrão “em favo de mel” com gradiente apicobasal.
No contexto clínico apropriado, quando todas estas caraterísticas estão presentes (o chamado padrão de “UIP típica”) e não há sinais imagiológicos sugestivos de um diagnóstico alternativo, diagnóstico de FPI pode ser feito sem recurso a biopsia pulmonar.4,5 Falamos de um padrão de “UIP provável” quando estamos perante um padrão reticular periférico de predomínio inferior, com bronquiectasias de tração, mas sem padrão “em favo de mel” inequívoco. Nestes casos, o diagnóstico mais provável continua a ser a FPI13, embora segundo a guideline conjunta da ATS/ERS seja necessária confirmação histológica nestes doentes.5 Por último, o padrão “indeterminado para UIP” foi introduzido apenas em 20184,5 e aplica-se quando existe um padrão reticular sem predomínio subpleural ou basal com alguns sinais imagiológicos menos frequentemente observados na FPI (fibrose com algum atingimento broncocêntrico ou opacidades em “vidro despolido” mais extensas do que o habitual, por exemplo). Nestes casos, a probabilidade de um diagnóstico de FPI vir a ser feito em reunião multidisciplinar ronda os 50%.3 Os achados imagiológicos em TCAR mais frequentes na pneumonia intersticial não- específica são as opacidades em “vidro despolido” bilaterais e de predomínio inferior, na maioria das vezes (75% dos casos) com espessamento septal intralobular associado (isto é, com reticulação), bronquiolectasias e bronquiectasias de tração.9,14,15 O padrão em “favo de mel” pode ocorrer, mas não é uma caraterística desta doença. Quando estas alterações “poupam” o parênquima pulmonar imediatamente sub-pleural (o chamado subpleural sparing), o diagnóstico de padrão pneumonia intersticial não-específica (NSIP) pode ser feito com mais confiança.14 Histologicamente, estas alterações traduzem a presença de inflamação e fibrose intersticial, com preservação da arquitetura pulmonar e com distribuição homogénea no tempo e no espaço2,9,15 (ao contrário da heterogeneidade temporal e espacial típica da UIP).
É preciso realçar, contudo, que quer o padrão UIP quer o padrão NSIP são padrões radiológicos e histológicos (e não doenças), podendo ser encontrados em muitos outros contextos clínicos (na pneumonite de hipersensibilidade fibrótica, no envolvimento pulmonar por conectivites, na asbestose ou na toxicidade farmacológica pulmonar, por exemplo). Esta afirmação é particularmente importante para o padrão NSIP, sendo muito mais frequentemente encontrado no contexto de uma doença de base (sendo o caso paradigmático as doenças do tecido conjuntivo) do que na forma idiopática16 (Figura 3).
Figura 3:
Pneumonia intersticial não-específica na esclerose sistémica. Padrão de opacificação em vidro despolido com reticulação intralobular associada e bronquiectasias de tração (setas), com predomínio inferior e distribuição relativamente homogénea. Nota-se ainda dilatação esofágica, habitual neste contexto (*).
As doenças do tecido conjuntivo (DTC) são um grupo heterogéneo de doenças inflamatórias sistémicas caraterizadas pela presença de autoanticorpos e lesão de órgão-alvo, sendo o pulmão um dos órgãos frequentemente envolvidos.2,17 Todos os componentes do tórax, nomeadamente as vias áereas, o interstício, a vasculatura pulmonar, a pleura e o pericárdio podem ser afetados nestas doenças.17-19 As DTC que mais frequentemente cursam com doença pulmonar difusa são a artrite reumatoide, a esclerose sistémica, o síndrome de Sjögren, as miosites (dermatomiosite/polimiosite), a doença mista do tecido conjuntivo e o lúpus eritematoso sistémico. Os padrões de envolvimento pulmonar pelas conectivites são histologicamente e radiologicamente semelhantes às suas equivalentes idiopáticas (padrão de UIP, NSIP, pneumonia organizativa, pneumonia intersticial linfocítica, bronquiolite obliterante, entre outras) e a sua frequência varia de acordo com a DTC subjacente19 (Tabela 1).
Tabela 2. Padrões de atingimento intersticial nas doenças do tecido conjuntivo
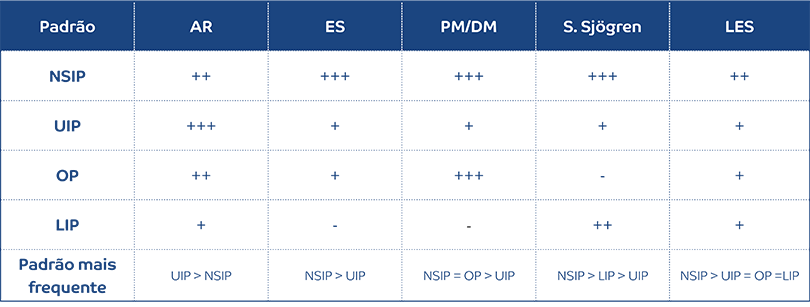
AR: artrite reumatoide; ES: esclerose sistémica; PM/DM: polimiosite/dermatomiosite; LES: lúpus eritematoso sistémico; NSIP: pneumonia intersticial não-específica; UIP: pneumonia intersticial usual; OP: pneumonia organizativa; LIP: pneumonia intersticial linfocítica. Adaptado de Ahuja J, et al. 2016.19
Regra geral, o padrão de NSIP é o mais frequentemente encontrado, exceto na artrite reumatoide onde o padrão de atingimento intersticial mais frequente é o padrão UIP.11,19 A coexistência de padrões (NSIP e pneumonia organizativa no contexto de uma miosite inflamatória, por exemplo) e o atingimento de vários compartimentos em simultâneo (coexistência de doença pulmonar intersticial com sinais de hipertensão pulmonar e derrame pleural/pleurite) é também uma caraterística do envolvimento pulmonar por conectivites. O radiologista deve também estar atento aos sinais extrapulmonares que possam ajudar no diagnóstico, nomeadamente: dilatação esofágica difusa, comum na esclerose sistémica; erosões das extremidades das clavículas na artrite reumatoide; calcificações dos tecidos moles na dermatomiosite; ou espessamento pleural e pericárdico (com ou sem derrame associado) no lúpus eritematoso sistémico.
A pneumonite de hipersensibilidade (PH) é uma doença complexa causada pela exposição continuada a um antigénio (mais comummente aviário, mas também microbiano ou químico), sendo a terceira causa mais frequente de doença pulmonar difusa (após a FPI e o envolvimento pulmonar pelas DTC).2,20 Os achados imagiológicos associados à pneumonite de hipersensibilidade refletem, na generalidade, a etiopatogenia da doença e traduzem-se por sinais de obstrução das pequenas vias aéreas (micronódulos centrilobulares, padrão de atenuação em mosaico ou air-trapping nos cortes obtidos em expiração) associadas a opacidades em “vidro despolido” (representando um processo inflamatório ou “infiltrativo”) com ou sem sinais de fibrose pulmonar. A recente guideline conjunta da American Thoracic Society/ Japanese Respiratory Society/Latin American Thoracic Association (ATS/ JRS/ALAT)6 para o diagnóstico de pneumonite de hipersensibilidade veio reclassificar esta doença nas categorias de PH não-fibrótica e PH fibrótica (por oposição à anterior classificação em PH aguda, subaguda e crónica). A este respeito, a coexistência de fibrose pulmonar e de sinais de obstrução bronquiolar é altamente sugestiva de PH fibrótica (Figura 4).
Figura 4:
Pneumonite de hipersensibilidade fibrótica. Opacidades reticulares irregulares com atingimento periférico e central (broncocêntrico), opacidades “em vidro despolido” e áreas lobulares de menor atenuação (setas) traduzindo obstrução das pequenas vias aéreas.
Os achados fibróticos na PH traduzem-se, na maioria das vezes, por um padrão reticular irregular com distorção arquitetural de distribuição difusa quer no plano axial quer no plano craniocaudal.6,20 A broncocentricidade dos achados fibróticos é também uma caraterística desta doença. A presença de bronquiectasias de tração ou de padrão “em favo de mel” é frequente, mas geralmente não constitui o padrão dominante. Um sinal imagiológico tido como específico de PH fibrótica é o “padrão das três densidades” (previamente chamado de padrão headcheese). Este sinal retrata a presença simultânea de três densidades pulmonares diferentes, coexistindo: (a) opacidades em vidro despolido (representando um processo inflamatório ou “infiltrativo”) e um padrão de atenuação em mosaico, constituído por (b) pulmão “normal” (de densidade intermédia), e (c) áreas lobulares de retenção aérea (de baixa densidade), traduzindo o processo obstrutivo das pequenas vias aéreas.6 Por último, salienta-se que, em alguns casos, a apresentação imagiológica pode ser virtualmente indistinguível da fibrose pulmonar idiopática (padrão de “UIP típica” ou “UIP provável”), da NSIP idiopática ou de uma DTC com atingimento pulmonar.
Apesar de não existir, à data, uma definição universalmente aceite de “progressão” de doença pulmonar fibrosante (as definições existentes provêm dos critérios utilizados nos ensaios clínicos de terapêutica antifibrótica), é regra, na prática clínica atual, uma avaliação clínica, funcional e imagiológica seriada destes doentes.1,21 Na maioria dos casos, a avaliação seriada através da TCAR demonstra progressão das áreas de fibrose (reticulação e padrão “em favo de mel”) ao longo do tempo. Contudo, atendendo à grande variabilidade fenotípica deste grupo de doenças, não é infrequente existir progressão funcional com estabilidade imagiológica (e vice-versa). O papel da avaliação seriada através da TCAR na avaliação do prognóstico destes doentes é controverso, sobretudo devido ao facto de a maioria dos estudos nesta área se basearem numa avaliação subjetiva por parte do radiologista.1,22 A introdução de técnicas automatizadas de quantificação de fibrose pulmonar é uma das áreas em maior desenvolvimento na radiologia torácica nos dias de hoje. Para além da avaliação da progressão da doença, a imagem é também importante no rastreio de comorbilidades associadas às doenças fibrosantes, nomeadamente o desenvolvimento de exacerbações agudas ou de neoplasias pulmonares.
1. Walsh SLF, Devaraj A, Enghelmayer JI, Kishi K, Silva RS, Patel N, et al. Role of imaging in progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150).
2. Cottin V, Hirani NA, Hotchkin DL, Nambiar AM, Ogura T, Otaola M, et al. Presentation, diagnosis and clinical course of the spectrum of progressive-fibrosing intersti-tial lung diseases. Eur Respir Rev. 2018;27(150).
3. Hobbs S, Chung JH, Leb J, Kaproth-Joslin K, Lynch DA. Practical Imaging Interpretation in Patients Suspected of Having Idiopathic Pulmonary Fibrosis: Official Recom-mendations from the Radiology Working Group of the Pulmonary Fibrosis Foundation. Radiol Cardiothorac Imaging. 2021;3(1):e200279.
4. Lynch DA, Sverzellati N, Travis WD, Brown KK, Colby TV, Galvin JR, et al. Diagnostic criteria for idiopathic pulmo-nary fibrosis: a Fleischner Society White Paper. The Lancet Respiratory Medicine. 2018;6(2):138-53.
5. Raghu G, Remy-Jardin M, Myers JL, Richeldi L, Ryerson CJ, Lederer DJ, et al. Diagnosis of Idiopathic Pulmonary Fibrosis. An Official ATS/ERS/ JRS/ALAT Clinical Practice Guideline. Am J Respir Crit Care Med. 2018;198(5): e44-e68.
6. Raghu G, Remy-Jardin M, Ryerson CJ, Myers JL, Kreuter M, Vasakova M, et al. Diagnosis of Hypersensi-tivity Pneumonitis in Adults. An Official ATS/JRS/ALAT Clinical Practice Guideline. Am J Respir Crit Care Med. 2020;202(3):e36-e69.
7. Hansell DM, Bankier AA, MacMahon H, McLoud TC, Muller NL, Remy J. Fleischner Society: glossary of terms for thoracic imaging. Radiology. 2008;246(3): 697- 722.
8. Watadani T, Sakai F, Johkoh T, Noma S, Akira M, Fuji-moto K, et al. Interobserver variability in the CT assess-ment of honeycombing in the lungs. Radiology. 2013; 266(3):936-44.
9. Travis WD, Costabel U, Hansell DM, King TE, Jr., Lynch DA, Nicholson AG, et al. An official American Thoracic Society/European Respiratory Society statement: Up-date of the international multidisciplinary classification of the idiopathic interstitial pneumonias. Am J Respir Crit Care Med. 2013;188(6):733-48.
10. Lederer DJ, Martinez FJ. Idiopathic Pulmonary Fibrosis. N Engl J Med. 2018;378(19):1811-23.
11. Wijsenbeek M, Cottin V. Spectrum of Fibrotic Lung Dis-eases. N Engl J Med. 2020;383(10):958-68.
12. Kusmirek JE, Martin MD, Kanne JP. Imaging of Idio-pathic Pulmonary Fibrosis. Radiol Clin North Am. 2016; 54(6):997-1014.
13. Chung JH, Chawla A, Peljto AL, Cool CD, Groshong SD, Talbert JL, et al. CT scan findings of probable usual interstitial pneumonitis have a high predictive value for histologic usual interstitial pneumonitis. Chest. 2015; 147(2):450-9.
14. Travis WD, Hunninghake G, King TE, Jr., Lynch DA, Colby TV, Galvin JR, et al. Idiopathic nonspecific interstitial pneu-monia: report of an American Thoracic Society project. Am J Respir Crit Care Med. 2008;177(12):1338-47.
15. Kligerman SJ, Groshong S, Brown KK, Lynch DA. Nonspecific interstitial pneumonia: radiologic, clinical, and pathologic considerations. Radiographics. 2009; 29(1):73-87.
16. Teoh AKY, Corte TJ. Nonspecific Interstitial Pneumonia. Semin Respir Crit Care Med. 2020;41(2):184-201.
17. Ruano CA, Lucas RN, Leal CI, Lourenco J, Pinheiro S, Fernandes O, et al. Thoracic manifestations of connec-tive tissue diseases. Curr Probl Diagn Radiol. 2015; 44(1):47-59.
18. Lynch DA. Lung disease related to collagen vascular disease. J Thorac Imaging. 2009;24(4):299-309.
19. Ahuja J, Arora D, Kanne JP, Henry TS, Godwin JD. Imaging of Pulmonary Manifestations of Connective Tissue Diseases. Radiol Clin North Am. 2016;54(6): 1015-31.
20. Magee AL, Montner SM, Husain A, Adegunsoye A, Vij R, Chung JH. Imaging of Hypersensitivity Pneumonitis. Radiol Clin North Am. 2016;54(6):1033-46.
21. Wong AW, Ryerson CJ, Guler SA. Progression of fibros-ing interstitial lung disease. Respir Res. 2020;21(1):32.
22. Walsh SLF. Imaging biomarkers and staging in IPF. Curr Opin Pulm Med. 2018;24(5):445-52.

-
Anatomopatologista
Serviço de Anatomia Patológica do Centro Hospitalar Universitário de São João

Nos mamíferos, a fibrose é a consequência final de agressão celular e/ou à matriz por virtualmente qualquer mecanismo (térmico, químico, hipóxico, traumático, infecioso, imunológico ou outro). Fibrose é não só um mecanismo de reparação, mas também de proteção do tecido de agressões futuras. É, essencialmente, um mecanismo adaptativo. No entanto agressões repetidas e persistentes podem levar a graus patogénicos de fibrose que alteram a função do órgão.1
No pulmão, a agressão repetida ao delicado parênquima alveolar pode levar à fibrose intersticial progressiva, que é um fator cardinal de uma variedade de doenças.
As doenças intersticiais fibrosantes caracterizam-se por inflamação e fibrose do parênquima, condicionando limitação nas trocas gasosas. A fibrose progressiva associa-se a agravamento dos sintomas respiratórios, resposta limitada à terapêutica imunomodeladora, diminuição da qualidade de vida e, potencialmente, morte.1
Fibrose progressiva é uma característica importante de muitas doenças intersticiais e condiciona a morbilidade e a mortalidade. Apesar de muitas das doenças que se apresentam com fibrose progressiva terem aspetos clínicos, imagiológicos e patológicos distintos, tem também sobreposição de muitas características que são semelhantes à clássica doença intersticial pulmonar com fenótipo fibrosante, a Fibrose Pulmonar Idiopática (FPI).
A FPI, que é uma entidade
clinicopatológica distinta, é a forma mais comum de
fibrose pulmonar difusa e
progressiva.2,6
Caracteriza-se
histologicamente pelo padrão de Pneumonia
Intersticial Usual (UIP): heterogeneidade espacial e
temporal, áreas de fibrose densa, focos
fibroblásticos, áreas de parênquima poupado e áreas
de padrão em favo de mel (Figura 1).
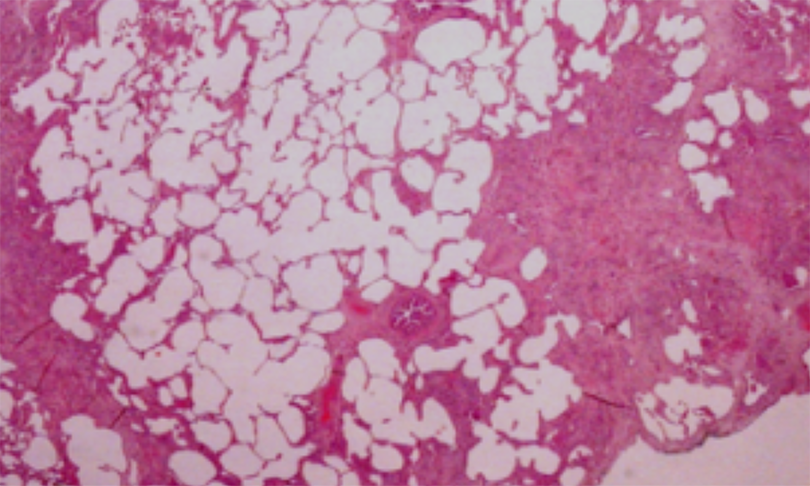
Figura 1: Biopsia cirúrgica HE40x - UIP. Áreas de fibrose densa alternando com parenquima pulmonar poupado.
A FPI é o arquétipo de uma doença fibrosante progressiva e pode ser vista como modelo das outras doenças intersticiais fibrosantes progressivas.2 Não é a única doença que leva a um end-stage de fibrose pulmonar. Várias outras pneumonias intersticiais podem ter este fenótipo fibrosante, como a pneumonia intersticial não especifica, pneumonia de hipersensibilidade, pneumonia intersticial associada a doenças do colagénio, sarcoidose e outras.
Doença pulmonar intersticial fibrosante progressiva foi redefinida como uma síndrome clinica que partilha características genéticas, patofisiológicas e história natural com a FPI.2
Pneumonite de hipersensibilidade - é uma
doença imunológica que se manifesta como doença
intersticial pulmonar em indivíduos suscetíveis, quando
expostos a um antígeno identificado ou não.3
Tem aspetos morfológicos que podem ser sobreponíveis a
outras pneumonias intersticiais. A pneumonite de
hipersensibilidade fibrótica difere da não fibrótica
porque para além da pneumonia intersticial crónica e/ou
bronquiolite é complicada de fibrose. A pneumonite de
hipersensibilidade fibrótica típica caracteriza-se por:
1 - pneumonia intersticial celular
centrada nas vias aéreas, assumindo por vezes um padrão
de NSIP celular e com predomínio de linfócitos.
2 - bronquiolite celular com predomínio
de linfócitos (linfócitos>plasmócitos), macrófagos
xantelasmizados nas vias aéreas terminais e pneumonia
organizativa.
3 - granulomas epitelioides malformados
não necrosantes.
4 - pneumonia fibrosante com distorção
arquitetural, focos fibroblásticos e favo de mel
sub-pleural; fibrose centrada nas vias aéreas com
metaplasia peri-bronquiolar (Figura 2).
Figura 2: Criobiopsia pulmonar transbrônquica HE 200x- Pneumonite de Hipersensibilidade - fibrose centolobular com metaplasia peribronquiolar.
Pneumonia intersticial não específica - histologicamente, a pneumonia intersticial não específica caracteriza-se por preservar a arquitetura do pulmão e envolver de forma uniforme o interstício.2 Observa-se infiltrado inflamatório intersticial mononuclear quase sempre associado a fibrose (Figura 3).
Figura 3: Criobiópsia pulmonar transbrônquica HE 200x - NSIP fibrose homogéneo do interstício pulmonar.
Pneumonia intersticial associada a doenças do
colagénio -
pneumonia intersticial ocorre em aproximadamente 15% dos
doentes com doença do colagénio, com maior incidência em
algumas patologias como esclerose sistémica e artrite
reumatoide.2
O padrão mais frequente de fibrose é de NSIP, mas um
padrão de UIP também pode ocorrer, particularmente na
artrite reumatoide, sendo que, neste caso, o diagnóstico
diferencial com FPI tem que ser feito. Alguns aspetos
morfológicos, como um infiltrado inflamatório
intersticial com predomínio de plasmócitos, pleurite e
coexistência de mais do que um padrão na biópsia,
favorecem envolvimento por doença do colagénio, bem como
a presença de bronquiolite folicular com centros
germinativos. Por outro lado, nestes casos existem
geralmente menos focos fibroblásticos do que na FPI
(Figura 4).
Figura 4: Criobiópsia pulmonar transbrônquica HE 100X: pleura com marcadas alterações reativas do mesotélio, fibrose e envolvimento por infiltrado inflamatório crónico com constituição de folículos linfoides, alguns com centro germinativo; parênquima pulmonar representado com espessamento homogéneo dos septos alveolares (NSIP fibrosante?).
No entanto, estas alterações podem ser discretas e têm que ser cuidadosamente avaliadas pelo patologista. O diagnóstico final é feito com base na integração dos aspetos histológicos com os fatores clínicos e imagiológicos.
Fibrose inclassificável - uma doença intersticial define-se como inclassificável quando os aspetos clínicos, imagiológicos ou histopatológicos são inadequados ou conflituosos entre si. Aproximadamente 10% das pneumonias intersticiais são inclassificáveis.5
Sarcoidose - é uma doença inflamatória rara, sistémica e de etiologia desconhecida. Resulta de uma resposta imunológica crónica a um antigénio desconhecido, em indivíduos geneticamente suscetíveis. Cerca de 90% dos doentes têm envolvimento pulmonar e cerca de 20% destes desenvolve fibrose (estádio IV).2 Caracteriza-se pela presença de granulomas epitelioides, bem formados e não necrosantes e, no estádio IV, fibrose que afeta predominantemente os segmentos posteriores dos lobos superiores e é centrada predominantemente nos eixos broncovasculares (Figura 5).
Figura 5: Criobiópsia pulmonar transbrônquica. HE 200x. Granulomas epitelioides bem formados, não necrosantes.
Doenças intersticiais relacionadas com exposição ocupacional - são causadas pela inalação e retenção no pulmão de várias partículas. As mais comuns são a abestose, causada pela inalação das fibras de asbestos e silicose relacionada com inalação de sílica.2 Na silicose simples observam- se pequenos nódulos de colagénio hialinizado, que ocorrem sobretudo nos lobos superiores. Nos casos avançados de silicose complicada, há confluência de nódulos, resultando em grandes massas com o desenvolvimento de fibrose progressiva predominantemente nos lobos superiores (Figura 6).
Figura 6: Criobiópsia pulmonar transbrônquica HE 200x - nódulo silicótico.
O processo chave que está na patogénese da fibrose pulmonar ocorre na FPI (neste caso, possivelmente como consequência da exposição ao tabaco, microaspiração ou exposição a tóxicos) e ocorre de forma semelhante nas outras doenças fibrosante específicas. Uma agressão pulmonar repetida, ambiental, genética, epigenética e/ou microbiológica, desencadeia uma cascata de eventos (dano epitelial/endotelial, alterações vasculares, disfunção imunológica) que condicionam uma reparação anormal. Ocorre uma resposta fibrótica patogénica na qual os fibroblastos se diferenciam em miofibroblastos, há acúmulo de matriz extracelular e fibrose progressiva.
O padrão UIP é considerado um padrão associado a mau prognóstico. Nos últimos anos, muita literatura se tem referido a aspetos histológicos que podem ser marcadores de mau prognóstico e influenciar a sobrevida dos doentes com diferentes doenças fibrosantes pulmonares.4 Muita dessa literatura foca-se na importância dos focos fibroblásticos como manifestação de agressão pulmonar ativa. Em particular na FPI, a quantidade de focos fibroblasticos pode estar relacionada com o declínio da função respiratória e mortalidade. Os focos fibroblásticos correspondem a áreas de matriz mixoide com agregados de miofibroblastos ativos, produtores de colagénio (Figura 7) e integram os aspetos morfológicos típicos da FPI.
Figura 7: Biópsia cirúrgica HE 400X - Foco fibroblástico.
No entanto, podem estar presentes em outras pneumonias
fibrosantes, nomeadamente pneumonia intersticial não
específica e pneumonite de hipersensibilidade, embora
sejam geralmente menos numerosos.
Estudos recentes demonstraram que a quantidade de focos
fibroblásticos presentes na biópsia está relacionada com
a gravidade das bronquiectasias de tração identificadas
na TCAR.4 Este aspeto pode explicar a
evidência crescente de que a severidade das
bronquiectasias de tração é um fator prognóstico
importante nas doenças fibrosantes do pulmão.
A exacerbação aguda é uma complicação devastadora na FPI. Apesar de não haver uma definição precisa de exacerbação aguda nas outras pneumonias intersticiais que não FPI, esta complicação pode ocorrer, é igualmente muito grave e com uma apresentação clínica semelhante. Uma vez que a função pulmonar se deteriora de forma irreversível após uma exacerbação aguda, este evento pode ser considerado como um indicador de fibrose progressiva.7
Os biomarcadores têm um papel promissor facilitando o diagnóstico precoce das doenças intersticiais, nomeadamente das que condicionam fibrose progressiva.
Algumas variantes genéticas que aumentam a suscetibilidade da FPI foram relacionadas com a fibrose progressiva noutras doenças intersticiais.8
MUC5B codifica uma proteína relacionada com a produção de muco nas vias aéreas. Polimorfismos deste gene, bem conhecidos como fator de risco genético para a FPI, estão também presentes em doentes com doença do interstício relacionada com a artrite reumatoide e na pneumonite de hipersensibilidade.8
Mutações nos genes TERT e TERC resultam em encurtamento dos telómeros e aumentam o risco de mortalidade na FPI. As mesmas alterações foram encontradas em doentes com pneumonias intersticiais associadas à artrite reumatoide.8
Encurtamento dos telómeros e polimorfismos de MUC5B foram associados a uma diminuição da sobrevida em doentes com pneumonite de hipersensibilidade fibrosante.8
1. Larsen BT, Smith ML, Elicker BM, et al. Diagnostic Approach to Advanced Fibrotic Interstitial Lung Disease: Bringing Together Clinical, Radiologic, and Histologic Clues. Arch Pathol Lab Med 2017; 141(7): 901-915.
2. Cottin V, Hirani NA, Hotchkin DL, et al. Presentation, diagnosis and clinical course of the spectrum of progressive-fibrosing interstitial lung diseases. Eur Respir Rev 2018; 27(150): 180076.
3. Raghu G, Remy-Jardin M, Ryerson CJ, et al. Diagnosis of Hypersensitivity Pneumonitis in Adults. An Official ATS/JRS/ALAT Clinical Practice Guideline. Am J Respir Crit Care Med 2020; 202(3): e36-e69.
4. Walsh SL, Wells AU, Sverzellati N, et al. Relationship between fibroblastic foci profusion and high resolution CT morphology in fibrotic lung disease. BMC Med 2015;13: 241.
5. Ryerson CJ, Urbania TH, Richeldi L, et al. Prevalence and prognosis of unclassifiable interstitial lung disease. Eur Respir J 2013; 42(3): 750-7.
6. Wuyts WA, Cavazza A, Rossi G, et al. Differential diagnosis of usual interstitial pneumonia: when is it truly idiopathic? EurRespir Rev 2014; 23(133):308-19.
7. George PM, Spagnolo P, Kreuter M, et al. Progressive fibrosing interstitial lung disease: clinical uncertainties, consensus recommendations, and research priorities. Lancet Respir Med 2020; 8(9): 925-934.
8. Adegunsoye A, Vij R, Noth I. Integrating Genomics Into Management of Fibrotic Interstitial Lung Disease. Chest 2019; 155(5): 1026-1040.

-
Pneumologista
Serviço de Pneumologia, Centro Hospitalar Universitário de São João, Porto
Faculdade de Medicina da Universidade do Porto, Porto
-
Pneumologista
Centro Hospitalar Universitário de São João, Porto

A fibrose pulmonar idiopática (FPI) integra o grupo das pneumonias intersticiais idiopáticas (PII) e é o protótipo da doença pulmonar intersticial (DPI) fibrosante, representando entre 17 e 86% de todos os casos.1 A verdadeira incidência e a prevalência de FPI são desconhecidas, devido à evolução dos critérios diagnósticos e à heterogeneidade metodológica dos estudos epidemiológicos realizados. Estima-se que a incidência varie entre 3-9/100.000 pessoas/ano.2
Durante décadas, as bases da fisiopatologia da FPI permaneceram largamente desconhecidas. A FPI resulta de um processo de cicatrização aberrante, que abrange o interstício pulmonar e os espaços alveolares, envolvendo uma interação complexa entre fatores externos (ambientais/ocupacionais; tabagismo; infeções; refluxo gastroesofágico; mecanismos de tração física na periferia do pulmão) e do próprio hospedeiro (predisposição genética).
A componente genética da FPI tem sido espelhada em várias linhas de investigação, estando descritas associações de variantes genéticas, raras e comuns, nas formas esporádicas (FPI) e familiares de fibrose pulmonar (FPF). As variantes genéticas raras (frequência de alelo minor < 1%) incluem mutações em genes relacionados com a estabilidade alveolar (SFTPC, SFT-PA1, SFTPA2, ABCA3 e NAF1), bem como em cinco genes ligados à biologia dos telómeros (TERT, TERC, DKC1, TINF2, RTEL1 e PARN). Dentro das variantes comuns (frequência de alelo minor > 5%), salienta-se o polimorfismo (rs35705950) na região promotora do gene da mucina 5B (MUC5B), o qual está fortemente associado ao risco de desenvolver FPI (30%) e FPF.3
Perante um estímulo lesivo persistente e crónico para o epitélio alveolar, em indivíduos suscetíveis, é desencadeado um processo de ativação fibroblástica epitélio-dependente, que se traduz na formação de focos de fibroblastos/miofibroblastos e na acumulação exagerada de matriz extracelular no parênquima pulmonar, conducente à gradual e irreversível distorção da arquitetura pulmonar.4
Apesar da preponderância do processo fibrogénico na patogénese da FPI, são descritos alguns componentes inflamatórios relevantes, nomeadamente a nível da resposta imune inata (por exemplo, CCL18 produzida por macrófagos M2; toll-like receptors - TLRS: TLR4; TLRA9; TLR3) e adquirida (linfócitos T e B).5 Por outro lado, existe uma evidência crescente sobre o papel do stress oxidativo no desenvolvimento e progressão de FPI. Sob estímulos contínuos, espécies reativas de oxigénio (reactive oxygen species [ROS]), como H2O2, radical superóxido e o radical hidroxilo, derivados das NADPH oxidases (NOX) e de mitocôndrias disfuncionais, são excessivamente produzidos, o que ativa as vias de transdução e causa a morte celular e a proliferação de fibroblastos.
Clinicamente, a FPI carateriza-se pelo desenvolvimento insidioso e progressivo de dispneia de esforço e/ou tosse, presença de crepitações inspiratórias bibasais na auscultação pulmonar e frequentemente hipocratismo digital. De salientar, a ausência de sintomas e sinais sugestivos de doença sistémica, nomeadamente de patologia autoimune, bem como exposição ambiental significativa ou toxicidade farmacológica. A exacerbação aguda da FPI, raramente, constitui a manifestação inicial da doença. Os doentes são maioritariamente do género masculino, com idade superior a 60 anos, e apresentam geralmente fatores de risco, como tabagismo, história familiar, ou refluxo gastroesofágico.
A tomografia computorizada com cortes de alta resolução (TCAR) é o método de diagnóstico central, cujo resultado define quatro categorias: padrão pneumonia intersticial usual (UIP); padrão UIP provável; indeterminado para UIP; e diagnóstico alternativo (Figura 1). 6 Num contexto clínico adequado, o padrão imagiológico de UIP “definitiva”, é patognomónico de FPI, com uma especificidade de 94-100%.7 Este padrão cursa com reticulação, bronquiectasias de tração e favo de mel de predomínio bibasal e subpleural, frequentemente num gradiente apicocaudal, na ausência de outros achados que possam sugerir um diagnóstico não-FPI, como áreas em mosaico, vidro despolido ou micronodulação.6 De salientar alguns achados radiológicos particulares: localização assimétrica (25%); ossificações nodulares (29%); associação com enfisema ou fibroelastose pleuropulmonar. Um padrão de UIP provável apresenta as mesmas alterações, exceto que não há evidência de favo de mel. Contudo, também num contexto clínico apropriado, este padrão assume relevância diagnóstica, correspondendo a cerca de 80% casos de UIP histológica. Por outro lado, só 30% dos casos de padrão indeterminado para UIP apresentam confirmação histológica de UIP.
Figura 1: Algoritmo diagnóstico para FPI. (a) Reticulação com predomínio subpleural e basal, de distribuição habitualmente heterogénea; alterações em favo de mel ± bonquiectasias de tração periféricas (b) Reticulação com predomínio subpleural e basal, de distribuição habitualmente heterogénea e com bonquiectasias de tração periféricas (sem favo de mel); pode ter discretas áreas de densidade de vidro despolido. (c) Reticulação subtil, sem óbvias caraterísticas de fibrose, ou áreas limitadas subpleurais/basais de opacificação em vidro despolido, que não sugere nenhuma etiologia específica, e que levanta a suspeita de UIP inicial.(d) Alterações sugestivas de outra etiologia: presença de cistos, marcada atenuação em mosaico, opacificação em vidro despolido dominante, consolidação, micronódulos dispersos, ou centrilobulares; distribuição predominante peribroncovascular, perilinfática, do andar superior ou médio do pulmão; presença de alterações pleurais (placas, espessamento, derrame), esófago dilatado, erosões claviculares distais, adenopatias relevantes. (e) Fibrose densa subpleural e parasseptal, com distorção da arquitetura pulmonar, alternando com áreas de pulmão não-afetado; presença de focos fibroblásticos e favo de mel.
Perante a necessidade de confirmação histológica do diagnóstico de FPI, e após a avaliação da relação risco/benefício, a biopsia pulmonar cirúrgica continua a ser o método mais consensual. 6 Este procedimento deverá ser efetuado, preferencialmente, por videotoracoscopia e com obtenção de múltiplas amostras referentes a dois ou mais lobos pulmonares, dada a possibilidade de coexistência de padrões histológicos distintos com implicações terapêuticas e prognósticas diferentes (por exemplo, UIP e pneumonia intersticial nãoespecífica [NSIP] fibrótica). A criobiopsia pulmonar transbrônquica é uma técnica endoscópica recente que permite a obtenção de amostras de tecido pulmonar de maior dimensão e qualidade do que a biopsia transbrônquica convencional.8 A sua acuidade diagnóstica é muito satisfatória, nomeadamente para os padrões de UIP e NSIP.
O padrão histológico de UIP, patognomónico de FPI, carateriza-se pela distorção da arquitetura do parênquima pulmonar, com fibrose colagenosa de predomínio subpleural e/ou parasseptal, favo de mel e focos fibroblásticos, com envolvimento heterogéneo, alternando com áreas de parênquima preservado (Figura 1). À semelhança do que foi descrito no âmbito da radiologia, também são reconhecidas quatro categorias histológicas: padrão UIP; UIP provável; indeterminado para UIP e diagnóstico alternativo.6
A integração dos dados clínicos, radiológicos e histológicos deverá ocorrer numa base multidisciplinar, com participação ativa de várias especialidades, incluindo a pneumologia, radiologia e anatomia patológica. O algoritmo proposto para o diagnóstico de FPI inicia-se pela avaliação do enquadramento clínico, seguida da realização de TCAR, cujos padrões de UIP e UIP provável, podem ser definitivamente diagnósticos em contexto clínico adequado, como já mencionado. Nas outras situações preconiza-se a confirmação histológica de FPI (Figura 1).
Em termos laboratoriais, a exclusão de outras etiologias faz-se pela realização de estudo sérico autoimune, particularmente com doseamento de anticorpos antinucleares, antipeptídeos citrulinados cíclicos e fator reumatoide, bem como pela realização de estudo celular de lavado broncoalveolar (LBA). Carateristicamente, o LBA na FPI revela uma neutrofilia, associada frequentemente com eosinofilia, podendo ocorrer uma linfocitose ligeira a moderada (7,2 e 26,7%).6 O consenso sobre diagnóstico FPI sugere a realização de estudo celular de LBA em situações de padrão imagiológico de UIP provável, UIP indeterminado ou diagnóstico alternativo.6 Por outro lado, continua a não estar recomendado o doseamento de biomarcadores séricos para distinguir FPI de outras doenças.
Invariavelmente, poderão ocorrer situações, em que apesar de uma extensa investigação e discussão multidisciplinar, não será possível obter um diagnóstico final. Nestes casos, recomenda-se assumir um diagnóstico provisório, e seguir atentamente o comportamento da doença ou resposta ao tratamento administrado, podendo rever-se o diagnóstico no caso de aparecimento de novos dados.
Foi apenas em 2014 que dois importantes ensaios, ASCEND para a pirfenidona9, e INPULSIS-1/-2 para o nintedanib10, conduziram à aprovação dos primeiros fármacos antifibróticos. A pirfenidona diminui a proliferação fibroblástica e a deposição de colagénio, contudo os seus alvos específicos não estão completamente esclarecidos. O nintedanib é uma pequena molécula inibidora da tirosina-cinase, incluindo os PDGFR α e β, FGFR 1-3 e o VEGFR 1-3, exercendo assim uma abrangente atividade antifibrótica e anti-inflamatória. Ambos antifibróticos reduzem em cerca de metade a taxa de declínio anual da capacidade vital forçada (FVC), face a placebo. Os estudos subsequentes RECAP e PASSPORT reforçaram a segurança e eficácia do tratamento com pirfenidona11, e o INPULSIS-ON com o uso prolongado do nintedanib.12 Atendendo ao caráter progressivo, e risco da ocorrência de exacerbação aguda, recomenda-se o início precoce do tratamento antifibrótico.13-15 Idêntico benefício do tratamento foi demonstrado em análise post hoc de subgrupos de doentes com FVC preservada nos ensaios ASCEND e CAPACITY (pirfenidona)16 e INPULSIS.17 Para doentes com doença mais avançada (FVC < 50% previsto e/ou DL COCO < 35% prev.), existem apenas estudos observacionais que sugerem uma desaceleração da FPI numa magnitude semelhante aos casos de doença menos avançada.18-21
O papel da N-acetilcisteína (NAC) no tratamento da FPI continua a ser alvo de debate. A NAC tem propriedades antioxidantes e antifibróticas, porém a sua utilização em ensaios clínicos aleatorizados controlados, quer por via oral22,23 quer inalada24, não demonstrou um benefício clínico adicional. Contudo, numa análise post hoc do ensaio PANTHER-IPF verificou-se que os doentes portadores do genótipo TT de um polimorfismo do gene TOLLIP (rs3750920) respondem ao tratamento com NAC oral, com redução do risco de eventos adversos (morte, transplante, hospitalização ou declínio de 10% da FVC)25, enquanto doentes com genótipo CC apresentaram agravamento do prognóstico.
Apesar de extremamente prevalente, o tratamento do refluxo gastroesofágico com antiácidos não tem eficácia consistente na prevenção de progressão da FPI, e em casos de doença mais avançada pode aumentar o risco de infeção respiratória.26 Não obstante, os melhores resultados em estudos pré-clínicos e observacionais prospetivos foram obtidos com inibidores de bomba de protões, e não com antagonistas dos recetores H2.27 Em doentes transplantados, o tratamento do refluxo associou-se com melhores resultados, possivelmente pela redução do risco da síndrome de bronquiolite obliterante.27
Com a progressão da FPI, as tarefas quotidianas tornam-se mais difíceis de executar, ocorrendo dessaturação de oxigénio durante o exercício, que frequentemente evoluem para hipoxemia em repouso. Está recomendado que doentes com insuficiência respiratória em repouso recebam oxigenoterapia de longa duração, embora não existam indicações específicas para a FPI. Os critérios para a instituição de oxigenoterapia mais comummente usados são adaptados da indicação na doença pulmonar obstrutiva crônica (DPOC): pressão parcial de oxigénio (PaO2) < 55 mmHg, ou PaO2 entre 55- 60 mmHg, quando associada a cor pulmonale, hipertensão pulmonar, ou poliglobulia (hematócrito > 55%). De forma similar, é habitual recomendar-se suplementação de oxigénio no exercício (oxigenoterapia de deambulação) quando doente apresenta SpO2 < 88% durante a prova de marcha de seis minutos (PM6M). Contudo, ao contrário da DPOC, não existe evidência consistente sobre os benefícios da oxigenoterapia na FPI, nomeadamente na redução da mortalidade.28 O ensaio AmbOx avaliou os efeitos da utilização de oxigénio de deambulação em doentes normoxémicos em repouso, mas com hipóxia no exercício, tendo demonstrado uma potencial melhoria dos sintomas e da qualidade de vida.29 Outros estudos mostraram aumento na capacidade de exercício com o oxigénio suplementar.28
A terapia de oxigénio de alto fluxo tem ganho crescente importância na hipoxemia refratária. Num estudo retrospetivo, a terapia de oxigénio de alto fluxo associou-se a sobrevida equivalente à observada em doentes sob ventilação não-invasiva (VNI) com insuficiência respiratória hipoxémica terminal, mas com melhor tolerância, com redução no trabalho respiratório, enquanto permitiu manter a capacidade de ingestão oral e de discurso nos últimos tempos de vida.30 Num estudo, doentes com DPI rapidamente progressiva que iniciaram precocemente VNI mostraram uma tendência para maior sobrevida.31
Contudo, mesmo em situações de dispneia intensa, a utilização de máscara facial e os picos de pressão positiva aplicados num pulmão pouco complacente para produzir um volume corrente adequado são habitualmente pouco tolerados pelo doente, pelo que o benefício da VNI no alívio sintomático de doentes com FPI não é consensual e geralmente não é recomendado.
A reabilitação respiratória tem o potencial de atenuar a dispneia e a ansiedade de doentes com fibrose pulmonar, melhora a tolerância ao exercício e os resultados dos testes de qualidade de vida.32 Numa análise recente a cinco ensaios aleatorizados controlados, verificou-se uma melhoria média de 16- 81 metros da distância percorrida na PM6M.33 Os programas de reabilitação usam os mesmos princípios aplicados em doentes com DPOC. As sessões incluem uma componente de treino de resistência em bicicleta estática ou marcha em passadeira, exercício de resistência dos membros superiores e de força funcional dos membros inferiores. O exercício deve ser monitorizado por um técnico especializado, garantindo o cumprimento do protocolo, e fornecido oxigénio suplementar se necessário durante o treino para obter saturações de oxigénio ≥ 85%. O programa pode ser complementado com exercícios nãosupervisionados no domicílio, de modo a que o doente cumpra cinco sessões de exercício por semana. O programa pode ser aplicado em qualquer fase da doença, e em doentes aguardando transplante pulmonar.
Apesar da controversa indicação do tratamento com antiácidos nos doentes com FPI, o ensaio de fase II WRAP-IPF demonstrou que a fundoplicatura laparoscópica em doentes com refluxo gastroesofágico anormal é segura e reduziu o declínio da FVC e a mortalidade.34
A referenciação precoce para uma consulta especializada de transplante é recomendada para permitir um processo de avaliação estruturado, com otimização de comorbilidades e educação do doente previamente à inclusão em lista ativa. A FPI é uma das principais indicações para transplante pulmonar.35 Apesar do benefício comprovado com a terapêutica antifibrótica, os critérios de referenciação para transplante36 continuam a incluir a evidência histológica ou imagiológica de UIP, com função respiratória alterada (FVC < 80% prev. e/ou DLCO < 40% prev.), causando limitação funcional ou dispneia, necessidade de oxigenoterapia em repouso ou de deambulação. Devem ser incluídos em lista de espera para transplante os doentes que evidenciem uma queda ≥ 10% da FVC ou de ≥ 15% da DLCO em seis meses; dessaturação na oximetria de pulso abaixo dos 88%, ou distância percorrida < 250 m, ou declínio > 50 m em seis meses na distância percorrida na PM6M; presença de hipertensão pulmonar; internamento por agravamento dos sintomas respiratórios, pneumotórax ou exacerbação aguda. Não existem contraindicações específicas para doentes com FPI serem transplantados, aplicando-se as diretrizes internacionais de âmbito geral.
A exacerbação aguda (EA) é definida como uma deterioração aguda (< 1 mês de duração) clinicamente significativa, de causa não-identificável, cujo diagnóstico é feito com base em cinco critérios:
- Diagnóstico prévio ou concorrente de FPI;
- Desenvolvimento ou aparecimento inexplicável de dispneia nos últimos 30 dias;
- Evidência de alterações (novas) bilaterais em “vidro despolido” e/ou de consolidação sobrepostas ao padrão de UIP em tomografia computorizada de alta resolução (TCAR) torácica;
- Ausência de evidência de infeção pulmonar, mediante o aspirado endotraqueal ou LBA, e
- Exclusão de causas alternativas.
Em alguns doentes, a EA pode ser a apresentação inicial da FPI, mas em geral ocorre com uma incidência variável entre 5 a 14% por ano após o diagnóstico, com maior frequência em casos de doença mais avançada.1 É um evento associado a mau prognóstico, com uma sobrevida mediana de cerca de três meses.32 Não há tratamento comprovadamente eficaz que altere significativamente estes resultados clínicos. A maioria dos doentes é tratada empiricamente com corticosteroides, que pode envolver pulsos de metilprednisolona intravenosa, seguidos de prednisolona via oral com desmame progressivo de acordo com evolução clínica. Dado o potencial papel dos microrganismos na precipitação de uma EA, e a sobreposição das caraterísticas clínicas com uma infeção respiratória, é habitual associar um curso de antibioterapia empírica. Outros tratamentos propostos incluem a trombomodulina recombinante humana solúvel, a hemoperfusão com polimixina B, plasmaferese, rituximab e imunoglobulina intravenosa, contudo a evidência destes tratamentos é ainda relativamente escassa.
A FPI tem um caráter cronicamente progressivo, havendo formas de evolução relativamente lenta e gradual, enquanto outras apresentam deterioração acelerada, por vezes pontuadas por episódios de exacerbação aguda. A sua evolução habitualmente culmina em insuficiência respiratória e morte num prazo médio de três a cinco anos após o diagnóstico.1 O início dos sintomas pode preceder entre um e quatro anos (mediana 2,2 anos) antes do diagnóstico, e o acesso mais tardio a um centro especializado associouse a uma taxa de mortalidade mais elevada.37 Os doentes rapidamente progressores são predominantemente homens, com cargas tabágicas mais elevadas e portadores de várias comorbilidades. Vários autores propuseram sistemas de estratificação de risco. Um dos mais usados é o índice GAP (gender, age, physiology), já validado em diferentes populações38 , que foi desenvolvido para estimar a mortalidade de doentes com FPI com recurso a quatro variáveis: género, idade, FVC e DLCO. Este sistema de pontuação define três estádios de gravidade (estádio I, II e III), que no estudo original se associaram a um risco de mortalidade ao primeiro ano após o diagnóstico de 6, 16 e 39%, respetivamente.39 A evolução longitudinal da função respiratória fornece informação de prognóstico mais robusta do que a avaliação basal. O declínio da FVC > 10%, da DLCO > 15%, ou da distância percorrida na PM6M > 50 m em 6-12 meses, associam-se a maior mortalidade e são critérios usados na referenciação ao transplante pulmonar.1,36
As comorbilidades têm um impacto significativo na qualidade de vida e sobrevida dos doentes com FPI. A importância de tratar o refluxo gastroesofágico sintomático já foi discutida acima. A hipertensão pulmonar (HTP) é outra complicação frequente em doentes com FPI avançada e associada a mau prognóstico, porém sem tratamento eficaz disponível neste contexto. Em algumas situações, a síndrome de apneia obstrutiva do sono (SAOS) concorre para o desenvolvimento de HTP, e contribui independentemente para a deterioração clínica mais acelerada.40
Cerca de um terço dos doentes com FPI apresentam enfisema combinado, que geralmente se carateriza por volumes pulmonares (capacidade pulmonar total [TLC], FVC) relativamente preservados e um défice de difusão alvéolocapilar (DLCO) desproporcionalmente baixo. A incidência de hipertensão pulmonar e de cancro é habitualmente superior neste grupo de doentes. De facto, a FPI é um fator de risco independente para o cancro do pulmão, o que representa uma dificuldade adicional pelo aumento do risco de exacerbação aguda associado ao tratamento oncológico, bem como pela limitação na ressecção cirúrgica em doentes com má função respiratória. Os dados sugerem que a terapêutica antifibrótica reduz a ocorrência de exacerbação de FPI em doentes com cancro submetidos a ressecção pulmonar41, e que os seus efeitos antiproliferativos podem atuar sinergicamente com a quimioterapia.
1. Wakwaya Y, Brown KK. Idiopathic Pulmonary Fibrosis: Epidemiology, Diagnosis and Outcomes. Am J Med Sci. 2019;357(5):359-69.
2. Ley B, Collard HR. Epidemiology of idiopathic pulmonary fibrosis. Clin Epidemiol. 2013;5:483-92.
3. Kaur A, Mathai SK, Schwartz DA. Genetics in Idiopathic Pulmonary Fibrosis Pathogenesis, Prognosis, and Treatment. Front Med (Lausanne). 2017;4:154.
4. Spagnolo P, Sverzellati N, Rossi G, Cavazza A, Tzouvelekis A, Crestani B, et al. Idiopathic pulmonary fibrosis: an update. Ann Med. 2015;47(1):15-27.
5. Lv M, Liu Y, Ma S, Yu Z. Current advances in idiopathic pulmonary fibrosis: the pathogenesis, therapeutic strategies and candidate molecules. Future Med Chem. 2019;11(19):2595-620.
6. Raghu G, Remy-Jardin M, Myers JL, Richeldi L, Ryerson CJ, Lederer DJ, et al. Diagnosis of Idiopathic Pulmonary Fibrosis. An Official ATS/ERS/ JRS/ALAT Clinical Practice Guideline. Am J Respir Crit Care Med. 2018;198(5): e44-e68.
7. Lynch DA, Sverzellati N, Travis WD, Brown KK, Colby TV, Galvin JR, et al. Diagnostic criteria for idiopathic pulmonary fibrosis: a Fleischner Society White Paper. Lancet Respir Med. 2018;6(2):138-53.
8. Casoni GL, Tomassetti S, Cavazza A, Colby TV, Dubini A, Ryu JH, et al. Transbronchial lung cryobiopsy in the diagnosis of fibrotic interstitial lung diseases. PLoS One. 2014;9(2):e86716.
9. King TE, Jr., Bradford WZ, Castro-Bernardini S, Fagan EA, Glaspole I, Glassberg MK, et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med. 2014;370(22):2083-92.
10. Richeldi L, du Bois RM, Raghu G, Azuma A, Brown KK, Costabel U, et al. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med. 2014; 370(22):2071-82.
11. Costabel U, Albera C, Lancaster LH, Lin CY, Hormel P, Hulter HN, et al. An Open-Label Study of the Long-Term Safety of Pirfenidone in Patients with Idiopathic Pulmonary Fibrosis (RECAP). Respiration. 2017;94(5):408-15.
12. Crestani B, Huggins JT, Kaye M, Costabel U, Glaspole I, Ogura T, et al. Long-term safety and tolerability of nintedanib in patients with idiopathic pulmonary fibrosis: results from the open-label extension study, INPULSIS-ON. Lancet Respir Med. 2019;7(1):60-8.
13. Cottin V, Crestani B, Cadranel J, Cordier JF, Marchand-Adam S, Prévot G, et al. [French practical guidelines for the diagnosis and management of idiopathic pulmonary fibrosis. 2017 update. Full-length update]. Rev Mal Respir. 2017.
14. Xaubet A, Molina-Molina M, Acosta O, Bollo E, Castillo D, Fernández-Fabrellas E, et al. Guidelines for the medical treatment of idiopathic pulmonary fibrosis. Arch Bronconeumol. 2017;53(5):263-9.
15. Robalo-Cordeiro C, Campos P, Carvalho L, Borba A, Clemente S, Freitas S, et al. Idiopathic pulmonary fibrosis in the era of antifibrotic therapy: Searching for new opportunities grounded in evidence. Rev Port Pneumol (2006). 2017;23(5):287-93.
16. Albera C, Costabel U, Fagan EA, Glassberg MK, Gorina E, Lancaster L, et al. Efficacy of pirfenidone in patients with idiopathic pulmonary fibrosis with more preserved lung function. Eur Respir J. 2016;48(3):843-51.
17. Kolb M, Richeldi L, Behr J, Maher TM, Tang W, Stowasser S, et al. Nintedanib in patients with idiopathic pulmonary fibrosis and preserved lung volume. Thorax. 2017;72(4):340-6.
18. Wuyts WA, Kolb M, Stowasser S, Stansen W, Huggins JT, Raghu G. First Data on Efficacy and Safety of Nintedanib in Patients with Idiopathic Pulmonary Fibrosis and Forced Vital Capacity of ≤50 % of Predicted Value. Lung. 2016;194(5):739-43.
19. Harari S, Caminati A, Poletti V, Confalonieri M, Gasparini S, Lacedonia D, et al. A Real-Life Multicenter National Study on Nintedanib in Severe Idiopathic Pulmonary Fibrosis. Respiration. 2018;95(6):433-40.
20. Tzouvelekis A, Ntolios P, Karampitsakos T, Tzilas V, Anevlavis S, Bouros E, et al. Safety and efficacy of pirfenidone in severe Idiopathic Pulmonary Fibrosis: A real-world observational study. Pulm Pharmacol Ther. 2017; 46:48-53.
21. Sakamoto S, Itoh T, Muramatsu Y, Satoh K, Ishida F, Sugino K, et al. Efficacy of pirfenidone in patients with advanced-stage idiopathic pulmonary fibrosis. Intern Med. 2013;52(22):2495-501.
22. Martinez FJ, de Andrade JA, Anstrom KJ, King TE, Jr., Raghu G. Randomized trial of acetylcysteine in idiopathic pulmonary fibrosis. N Engl J Med. 2014; 370(22):2093-101.
23. Behr J, Bendstrup E, Crestani B, Günther A, Olschewski H, Sköld CM, et al. Safety and tolerability of acetylcysteine and pirfenidone combination therapy in idiopathic pulmonary fibrosis: a randomised, double-blind, placebo-controlled, phase 2 trial. Lancet Respir Med. 2016;4(6):445-53.
24. Sakamoto S, Kataoka K, Kondoh Y, Kato M, Okamoto M, Mukae H, et al. Pirfenidone plus inhaled N-acetylcysteine for idiopathic pulmonary fibrosis: a randomised trial. Eur Respir J. 2021;57(1).
25. Oldham JM, Ma SF, Martinez FJ, Anstrom KJ, Raghu G, Schwartz DA, et al. TOLLIP, MUC5B, and the Response to N-Acetylcysteine among Individuals with Idiopathic Pulmonary Fibrosis. Am J Respir Crit Care Med. 2015; 192(12):1475-82.
26. Kreuter M, Wuyts W, Renzoni E, Koschel D, Maher TM, Kolb M, et al. Antacid therapy and disease outcomes in idiopathic pulmonary fibrosis: a pooled analysis. Lancet Respir Med. 2016;4(5):381-9.
27. Wang Z, Bonella F, Li W, Boerner EB, Guo Q, Kong X, et al. Gastroesophageal Reflux Disease in Idiopathic Pulmonary Fibrosis: Uncertainties and Controversies. Respiration. 2018;96(6):571-87.
28. Bell EC, Cox NS, Goh N, Glaspole I, Westall GP, Watson A, et al. Oxygen therapy for interstitial lung disease: a systematic review. Eur Respir Rev. 2017;26(143).
29. Visca D, Mori L, Tsipouri V, Fleming S, Firouzi A, Bonini M, et al. Effect of ambulatory oxygen on quality of life for patients with fibrotic lung disease (AmbOx): a prospective, open-label, mixed-method, crossover randomised controlled trial. Lancet Respir Med. 2018;6(10):759-70.
30. Koyauchi T, Hasegawa H, Kanata K, Kakutani T, Amano Y, Ozawa Y, et al. Efficacy and Tolerability of High-Flow Nasal Cannula Oxygen Therapy for Hypoxemic Respiratory Failure in Patients with Interstitial Lung Disease with Do-Not-Intubate Orders: A Retrospective Single-Center Study. Respiration. 2018;96(4):323-9.
31. Yokoyama T, Tsushima K, Yamamoto H, Koizumi T, Kubo K. Potential benefits of early continuous positive pressure ventilation in patients with rapidly progressive interstitial pneumonia. Respirology. 2012;17(2):315-21.
32. Spagnolo P, Tzouvelekis A, Bonella F. The Management of Patients With Idiopathic Pulmonary Fibrosis. Frontiers in Medicine. 2018;5(148).
33. Vainshelboim B. Clinical Improvement and Effectiveness of Exercise-Based Pulmonary Rehabilitation in Patients With Idiopathic Pulmonary Fibrosis: A BRIEF ANALYTICAL REVIEW. J Cardiopulm Rehabil Prev. 2021;41(1):52-7.
34. Raghu G, Pellegrini CA, Yow E, Flaherty KR, Meyer K, Noth I, et al. Laparoscopic anti-reflux surgery for the treatment of idiopathic pulmonary fibrosis (WRAP-IPF): a multicentre, randomised, controlled phase 2 trial. Lancet Respir Med. 2018;6(9):707-14.
35. Shah PD, Orens JB. Guidelines for the selection of lung-transplant candidates. Curr Opin Organ Transplant. 2012; 17(5):467-73.
36. Weill D, Benden C, Corris PA, Dark JH, Davis RD, Keshavjee S, et al. A consensus document for the selection of lung transplant candidates: 2014 - an update from the Pulmonary Transplantation Council of the International Society for Heart and Lung Transplantation. J Heart Lung Transplant. 2015;34(1):1-15.
37. Lamas DJ, Kawut SM, Bagiella E, Philip N, Arcasoy SM, Lederer DJ. Delayed access and survival in idiopathic pulmonary fibrosis: a cohort study. Am J Respir Crit Care Med. 2011;184(7):842-7.
38. Lee SH, Kim SY, Kim DS, Kim YW, Chung MP, Uh ST, et al. Predicting survival of patients with idiopathic pulmonary fibrosis using GAP score: a nationwide cohort study. Respir Res. 2016;17(1):131.
39. Ley B, Ryerson CJ, Vittinghoff E, Ryu JH, Tomassetti S, Lee JS, et al. A multidimensional index and staging system for idiopathic pulmonary fibrosis. Ann Intern Med. 2012;156(10):684-91.
40. Bosi M, Milioli G, Fanfulla F, Tomassetti S, Ryu JH, Parrino L, et al. OSA and Prolonged Oxygen Desaturation During Sleep are Strong Predictors of Poor Outcome in IPF. Lung. 2017;195(5):643-51.
41. Iwata T, Yoshino I, Yoshida S, Ikeda N, Tsuboi M, Asato Y, et al. A phase II trial evaluating the efficacy and safety of perioperative pirfenidone for prevention of acute exacerbation of idiopathic pulmonary fibrosis in lung cancer patients undergoing pulmonary resection: West Japan Oncology Group 6711 L (PEOPLE Study). Respir Res. 2016;17(1):90.

-
Reumatologistas
Serviço de Reumatologia do Hospital Garcia de Orta
-
Reumatologista
Serviço de Reumatologia do Centro Hospitalar e Universitário de Coimbra
-
Pneumologista
Serviço de Pneumologia do Centro Hospitalar e Universitário de Coimbra

A esclerose sistémica (ES) é uma doença do tecido conjuntivo (DTC) imunomediada, caracterizada por alterações vasculares, produção de anticorpos e fibrose progressiva, que geralmente afeta a pele, mas que também pode atingir órgãos internos.
Existem três formas de esclerose sistémica:
- Forma cutânea limitada
- Forma cutânea difusa
- ES sine escleroderma
A diferença entre estas formas está na extensão do envolvimento da pele. Os critérios de diagnóstico foram revistos em 2013 pela European League Against Rheumatism (EULAR) e pela American College of Rheumatology, o que permitiu aumentar a sensibilidade (91%) e a especificidade (92%) para o diagnóstico da ES.1
É uma doença rara, que atinge preferencialmente mulheres jovens e de meia idade, sendo causa de grande morbilidade e mortalidade. A causa da ES é ainda desconhecida e provavelmente resulta da combinação de vários fatores: genéticos, imunológicos, ambientais, hormonais. O envolvimento pulmonar é comum nestes doentes, sendo atualmente a principal causa de morte na ES. Varia consoante a forma de doença, podendo atingir até 80% dos doentes.2
As formas mais comuns de envolvimento pulmonar são a doença pulmonar intersticial (DPI) e a doença vascular pulmonar. Há outras alterações pulmonares que podem surgir, como a doença tromboembólica, doença pleural, pneumonites de aspiração, doença das vias aéreas, pneumonite induzida por drogas e neoplasia do pulmão.
A prevalência de DPI na ES varia muito, consoante a definição de diagnóstico e a população estudada. Num estudo publicado em 2014, cerca de 50% dos doentes com forma cutânea difusa, e 25% com forma limitada, tinham DPI na TCAR pulmonar. Mas há estudos com percentagens maiores de alterações.3
O envolvimento pulmonar intersticial (DPI) da esclerose sistémica atinge entre 50 a 90% dos pacientes com ES, dependendo dos métodos de diagnóstico ou das populações estudadas. Este tipo de envolvimento pode ser encontrado tanto na forma difusa como na forma limitada, embora seja mais frequente na primeira.4
O padrão imagiológico e histológico mais frequente é a pneumonia intersticial não específica (NSIP) em mais de 75% dos casos, seguida pela pneumonia intersticial usual (UIP) em muito menor escala (cerca de 15%). Outros padrões mais raros podem ser encontrados apenas ocasionalmente, como a pneumonia organizativa (OP) ou o dano alveolar difuso (DAD). Num estudo de Bouros e colegas, a prevalência de NSIP situou-se nos 77,5%, sendo a variante fibrótica dominante (76%).5 Este facto justifica, assim, que embora o achado imagiológico essencial e mais frequente seja o vidro despolido, a regressão com o tratamento é rara (menos de 5% dos casos), o que sugere que o vidro despolido observado nestes pacientes resulte maioritariamente de fibrose inicial e não de inflamação, não identificado desta forma na TCAR por resolução insuficiente. Esta circunstância é ainda corroborada pelo facto de que estas áreas são progressivamente substituídas por fibrose instituída (favo de mel, bronquiectasias de tração e reticulação), independentemente da terapia efetuada.
O padrão UIP nestes pacientes é menos grave em termos prognósticos, o que parece estar relacionado com o achado histológico de maior número de centros germinativos e menos focos fibroblásticos.6
A DPI é mais frequente e mais precoce nos doentes com esclerose sistémica com forma cutânea difusa, com anticorpos anti-topoisomerase 1 positivos, nos indivíduos de raça negra.
São considerados fatores de pior prognóstico para DPI: presença de anticorpos antitopoisomerase (SCL-70) positivos, envolvimento cutâneo difuso, afroamericanos, sexo masculino, gravidade da doença (avaliada por tomografia computadorizada e provas de função pulmonar), curto tempo de evolução da doença sistémica (< 5 anos), agravamento funcional e radiológico no seguimento, alterações na capilaroscopia e úlceras digitais. Mais recentemente tem-se vindo a constatar a relação entre risco de envolvimento pulmonar e a positividade para outros anticorpos, como por ex. Anti-citoplasma de neutrófilo, Anticardiolipinas, AntiRo52, Anti-NOR90, Anti-U11/12, Anti-Th/To, Anti-PmScl.7,8
Dada a prevalência e gravidade do envolvimento pulmonar, todos os doentes com ES devem fazer rastreio para a DPI e para a hipertensão arterial pulmonar (PAH), no início do seguimento da doença e depois, periodicamente.9
Recomenda-se que este rastreio inclua uma avaliação clínica, o doseamento de autoanticorpos, o doseamento do N-terminal pro-brain natriuretic peptide (NT-proBNP) ou o BNP, Provas de Função Ventilatória (PFV), Tomografia computorizada de alta resolução (TCAR) e Ecocardiograma com Doppler.
A avaliação clínica deve incluir o inquérito sistemático completo, não esquecendo hábitos tabágicos, medicamentosos, exposições ambientais, seguido de exame objetivo cuidadoso, dando particular relevância a alterações de novo ou ao agravamento das já existentes (ex. tosse, dispneia, fervores, etc.)
O tipo de autoanticorpos apresentados pelo doente é muito relevante para uma avaliação do risco e prognóstico da doença, como já referido.
O doseamento de NT-proBNP ou BNP é útil para screening da PAH, bem como o Ecocardiograma com Doppler.
As PFV (espirometria, volumes pulmonares e a capacidade de difusão do monóxido de carbono - DLCO) são de extrema importância na avaliação inicial destes doentes, permitindo avaliar a presença de um padrão restritivo ou alterações da difusão precocemente. Podem ser complementadas com a realização da prova da marcha dos 6 minutos.
A combinação de volumes pulmonares reduzidos e redução da DLCO sugere DPI. Contudo, todos os parâmetros das PFV devem ser avaliados, para minimizar o risco de falsos negativos. Diminuição >10% da FVC, ou diminuição >15% da DLCO, identifica um risco aumentado de morte.
Também a combinação com a avaliação pulmonar por TCAR é aqui essencial para aumentar a sensibilidade para as alterações da DPI. 10,11 Na TCAR vamos procurar as alterações características (imagens em vidro despolido, reforço reticular, imagens em favo de mel, etc.), bem como a sua distribuição. A presença de DPI na baseline correlaciona-se com progressão da doença pulmonar.11
Nos primeiros anos de evolução da doença (pelo menos 5), as PFV devem ser realizadas anualmente ou a cada 6 meses, consoante os fatores de risco, com avaliação da DLCO, sendo acompanhadas de uma avaliação clínica cuidadosa. Se não houver alterações, podemos depois espaçar estas PFV para cada 2 anos.
A TCAR deve ser repetida se houver de novo sintomas ou alterações nas PFV.
A ecografia pulmonar tem mostrado resultados promissores na avaliação da DPI e, no futuro, pode vir a ser utilizada como método de rastreio, evitando a exposição a radiação como acontece na TCAR.
O envolvimento intersticial na esclerose sistémica é muitas vezes indolente e, por esse motivo, pouco sintomático numa fase inicial. Particularmente se houver envolvimento de outros órgãos como a pele, o músculo ou o esófago, os sintomas podem ser mascarados por estas condições. Os sintomas mais frequentes são a dispneia de esforço e a tosse, que se podem acompanhar de fervores crepitantes tipo velcro de predomínio basal ao exame objetivo.
As PFV são essenciais para a avaliação do impacto funcional do envolvimento intersticial, conferindo um padrão restritivo com diminuição da DLCO. No entanto, o curso clínico em termos funcionais é muito heterogéneo. No estudo da EUSTAR, cerca de 40% dos doentes apresentaram uma alteração ventilatória do tipo restritivo moderada a grave, estando a última associada a uma taxa de mortalidade de 42% aos 10 anos.12 Num outro estudo, aqueles com uma capacidade vital forçada (FVC) inicial ≥80% (51%) raramente apresentaram declínio funcional sendo irregular a evolução dos restantes. Apesar de altamente variável, o declínio funcional ocorre habitualmente nos 3-4 anos após o aparecimento de sintomas, seguindo posteriormente um curso indolente.6
A TC torácica de alta resolução (TCAR) é o exame gold standard para identificação das alterações intersticiais, dada a maior sensibilidade em relação à radiografia convencional, particularmente em fases iniciais. O padrão imagiológico mais habitual é a NSIP fibrótica (mais de 75% dos casos), caracterizada por opacidades em vidro despolido, reticulação, bronquiectasias de tração e mais raramente favo de mel, de predomínio nos andares inferiores. O padrão UIP será o segundo mais frequente (entre 10 a 15% dos doentes), sendo residuais outras formas de envolvimento, designadamente OP ou DAD.13
Mais recentemente, a ecografia torácica tem apresentado bons resultados na identificação de envolvimento intersticial, o que poderá vir a ser uma alternativa à TCAR, particularmente pelo efeito nocivo da radiação que esta acarreta. Outras modalidades de imagem estão em desenvolvimento, como a ressonância magnética ou a PET, para além da análise quantitativa aplicada à TCAR.
A realização de broncofibroscopia com lavagem broncoalveolar não é essencial numa perspetiva de diagnóstico, uma vez que não existem resultados específicos em estudos prévios. Contudo, pode ser importante na exclusão de infeção ou na identificação de diagnósticos alternativos (outra DPI, neoplasia).
A biopsia cirúrgica reserva-se apenas para casos em que existe uma discordância clinico-radiológica, podendo o aporte de informação histológica trazer maior segurança diagnóstica. No entanto, o risco de complicações não é desprezível, particularmente o risco de exacerbação de doença intersticial e de mortalidade.
Em todos os doentes com ES, devemos considerar medidas preventivas gerais de tratamento. Como quase todos estes doentes têm refluxo gastroesofágico, pelo envolvimento local da ES, devemos tratar esta condição (ex. inibidores da bomba de protões, anti-histamínicos H2, agentes procinéticos, adaptação do estilo de vida). É também recomendado vacinar estes doentes contra a gripe e contra a infeção por Pneumococos.
Num doente com ES e DPI, é controverso quando se deve iniciar tratamento e qual o melhor tratamento a usar. Regra geral, se o doente estiver sintomático ou houver sinais de progressão da doença, deve ser iniciado tratamento com um imunossupressor. Contudo, dada a modesta eficácia que estes fármacos podem ter e a toxicidade potencial, deve ser avaliado o risco/beneficio, tratando consoante o caso, sendo que os doentes mais graves e de maior risco devem sempre fazer tratamento. O tratamento deve ser iniciado precocemente, antes da evolução natural da doença para fibrose irreversível.
Doentes que apresentem nas PFV um declínio da FVC e/ou da DLCO, têm provavelmente doença ativa e devem iniciar tratamento. De igual modo, a presença de alterações na TCAR > 20% representam doença ativa, com maior risco de agravamento da doença e mortalidade.
A escolha do fármaco inicial tem recaído sobre o Micofenolato Mofetil (MMF), muito baseado nos resultados do Scleroderma Lung Study II, que compara este fármaco com a ciclofosfamida, revelando um bom perfil de eficácia e de segurança para o MMF.14
O MMF é utilizado geralmente numa dose entre 1,5 e 3g, dividido em 2 tomas, sendo os principais efeitos secundários alterações gastrointestinais e toxicidade medular. É um fármaco muito bem tolerado, mesmo por períodos prolongados de tempo, mostrando ser eficaz em melhorar os sintomas e os sinais de DPI, ou em estabilizar as alterações observadas.
A ciclofosfamida tem sido recomendada como 2ª linha de tratamento ou como alternativa ao MMF. A forma oral é adaptada ao peso (>= 2mg/Kg) e administrada durante 1 ano. No Scleroderma Lung Study I, mostrou ser eficaz com melhoria clínica e radiológica, bem como nas PFV com estabilização da FVC.15
A grande preocupação recai na toxicidade da ciclofosfamida, pelo que se tem dado preferência à toma endovenosa em vez da toma oral, sendo administrado IV mensalmente durante 6 meses, permitindo uma menor dose cumulativa e maior facilidade de hidratação. Esta via de administração provou ser também eficaz.16 Durante o tratamento deve-se monitorizar mensalmente o leucograma e a função renal (creatinina e sedimento urinário), para controlo de possíveis efeitos secundários. Contudo, cerca de um ano após a suspensão da ciclofosfamida, os benefícios observados desaparecem, pelo que se deve fazer uma terapêutica de manutenção com o MMF ou com azatioprina.
Os corticosteróides não devem ser utilizados nestes doentes, principalmente em doses altas, dado o risco de uma crise renal esclerodérmica, que é uma complicação muito grave e potencialmente fatal. Contudo, muitos dos doentes referidos nos estudos com os tratamentos anteriores, tomaram concomitantemente doses baixas de prednisolona (<10 mg/dia), sendo incerta a eficácia desta dose.
A azatioprina pode ser uma alternativa para doentes que não possam fazer MMF ou ciclofosfamida, mas parece ser menos eficaz como tratamento inicial da DPI.
Em doentes em que há progressão da doença, apesar do tratamento instituído, ou que não possam fazer MMF ou ciclofosfamida, o uso de Nintedanib pode ser uma boa opção. Este pode ser dado sozinho ou em associação com o MMF e demonstrou atrasar a progressão para fibrose no pulmão, diminuindo o declínio da FVC observada.17
O Rituximab foi também usado em doentes com DPI, mas os resultados observados são controversos, necessitando de mais estudos para se poder confirmar a sua eficácia nesta patologia. Contudo, em alguns estudos demonstrou ser eficaz, melhorando os valores de FVC e de DLCO, devendo ser considerado na doença refratária.
O Tocilizumab tem sido utilizado como tratamento alternativo, mas necessita de mais estudos para melhor definição de eficácia.
Outra opção a ter em conta é o transplante autólogo de células-tronco hematopoiéticas, muito eficaz na estabilização e mesmo regressão de lesões estabelecidas, mas com riscos importantes a indicar. Deve ser considerado quando há progressão da doença e risco de envolvimento de órgão.
Por fim, o transplante pulmonar pode ser considerado, para doentes muito selecionados com doença grave.
Figura 1: Sugestão de algoritmo de tratamento do envolvimento pulmonar intersticial na ES (adaptado de Systemic Sclerosis-associated interstitial lung disease. Lancet 2020; vol 8, Issue 3: 304:320)
TCAR: TAC de alta resolução; FVC: capacidade vital forçada; PFV: Provas de função ventilatória.
Deve ser feita uma monitorização regular de possíveis efeitos secundários dos medicamentos utilizados, consoante o medicamento em causa e ajustada a dose e o tratamento utilizado.
Quanto à avaliação da resposta à terapêutica, é feita essencialmente pelos sinais e sintomas observados e pela realização de PFV regulares (entre 3 a 6 meses). Muitas vezes a estabilização da função pulmonar já evidencia um resultado satisfatório ao tratamento. Uma melhoria dos sintomas ou dos valores das PFV pode ser muito lenta e mascarada por fibrose pré-existente.
Devemos sempre ter em conta que podem existir outras situações concomitantes que podem levar a um agravamento clínico, como por exemplo a HAP.
Num doente com ES, o facto de ter envolvimento pulmonar intersticial aumenta o risco de mortalidade.18 A idade avançada, diminuição da FVC e da DLCO e a extensão da doença na TCAR, são fatores preditores de mortalidade. A sobrevida destes com DPI a 10 anos é significativamente inferior à dos doentes com ES e sem DPI.
Segundo um estudo realizado pelo “EULAR Scleroderma Trials and Research (EUSTAR)”, a presença de fibrose pulmonar contribuiu para 35% de mortalidade especifica da doença.19
A sobrevivência destes doentes vai depender de se fazer um diagnóstico o mais precoce possível do envolvimento DPI e de se iniciar terapêutica dirigida. É, por isso, muito importante um seguimento e uma monitorização regulares destes doentes.
A artrite reumatoide (AR) é uma artropatia inflamatória crónica que atinge preferencialmente mulheres, com uma idade média de início dos sintomas entre os 40 e os 60 anos.
As articulações preferencialmente afetadas são os punhos e as pequenas articulações das mãos e dos pés. Além disso, muitos doentes apresentam também um amplo espetro de manifestações extra-articulares, entre as quais doença pulmonar intersticial (DPI).
Em termos imunológicos, cerca de 70-80% dos doentes com AR apresenta fator reumatoide (FR) positivo e 60-70% anticorpos anti-péptidos citrulinados positivos (CCP). Apesar de importantes em termos de diagnóstico e prognóstico, a ausência destes marcadores não exclui o diagnóstico de AR.
Os dados disponíveis na literatura sobre a prevalência da DPI associada a AR apresentam grande variabilidade, que se deve sobretudo à metodologia utilizada para o seu diagnóstico. A prevalência de doença sintomática situa-se entre os 2-8% dos doentes com AR.20 Contudo, muitos doentes são assintomáticos/ oligosintomáticos, pelo que a prevalência de doença subclínica, detetada apenas em exames de imagem, é francamente superior, entre os 10-50%.20 Esta diferença de valores ilustra a importância da elaboração de um protocolo de seguimento dos doentes com AR que vise a deteção de DPI o mais precocemente possível, idealmente antes do aparecimento de sintomas.
Além disso, é importante referir que, numa minoria de doentes, as manifestações extra-articulares, neste caso a DPI, podem ser a primeira manifestação da doença.21 Este facto está relacionado com a fisiopatologia da AR, na qual o processo de citrulinação proteica fundamental para a génese da inflamação ocorre em várias localizações extra-articulares, nomeadamente a nível pulmonar.22 Por este motivo, alguns doentes podem apresentar DPI e anticorpos anti-CCP positivos, sem evidência de doença articular.
Existem vários fatores que aumentam o risco de os doentes com AR desenvolverem DPI, os quais incluem género masculino, idade tardia, tabagismo, duração da AR, positividade do FR e/ou anticorpos anti-CCP, elevação de parâmetros inflamatórios, atividade articular moderada/alta, presença de nódulos reumatoides e fatores genéticos, nomeadamente uma variante do promotor do gene MUC5B.20
Os dados existentes na literatura referentes à toxicidade pulmonar associada aos fármacos utilizados no controlo da AR são controversos.20,22 Se por um lado existem relatos de casos de DPI induzida/agravada por estes fármacos, é fundamental referir que a maioria dos doentes sob esta terapêutica apresenta doença com elevada atividade, que só por si constitui um fator de risco para o desenvolvimento de DPI, e que é muitas vezes refratária à terapêutica instituída, sendo que nestes casos a progressão da doença poderá ser erroneamente interpretada como toxicidade farmacológica.20,22 Além disso, nem sempre é fácil distinguir toxicidade farmacológica de eventuais infeções, cujo risco é superior nos doentes sob imunossupressão.22
Até à data, praticamente todos os fármacos utilizados no tratamento da AR (glucocorticoides, fármacos modificadores da doença sintéticos e biológicos) foram documentados como potenciais indutores de DPI.20,22 Contudo, a toxicidade pulmonar do metotrexato é a mais frequentemente reportada e a que mais preocupa os pneumologistas. A pneumonite associada ao metotrexato está descrita em 0.86-6.9% dos doentes e na maioria dos casos surge no primeiro ano de terapêutica.3 Caracteriza-se pelo início agudo de febre, dispneia e tosse seca, com presença de opacidades pulmonares difusas em exames radiográficos, que resolvem com a suspensão do fármaco.22 No entanto, já vários estudos demonstraram não existir qualquer associação entre o uso de metotrexato e o desenvolvimento de DPI, parecendo inclusivamente existir um papel protetor do fármaco no que diz respeito à DPI, ao controlar a atividade da AR.23
Na prática clínica é fundamental avaliar o risco-benefício associado a cada fármaco, sendo que a eventual suspensão do tratamento deverá sempre ser sempre uma decisão individualizada e partilhada entre reumatologista e pneumologista.
Ao contrário da maioria das doenças reumáticas sistémicas, o padrão radiográfico e histopatológico de DPI mais comum nos doentes com AR é o de pneumonia intersticial usual (UIP), descrito em 40-62% dos casos.24 O segundo padrão mais frequente é o de pneumonia intersticial não específica (NSIP), presente em 11-38%.5 Outros padrões como pneumonia organizativa (OP), pneumonia intersticial linfocitícia (LIP), pneumonia intersticial descamativa e lesão alveolar difusa estão também descritos, mas são raros.22
As decisões referentes ao tratamento da DPI associada a AR têm por base a gravidade e a progressão do envolvimento pulmonar, sendo que o principal objetivo do tratamento é atrasar a sua progressão. Até ao momento não existem fármacos aprovados especificamente para o tratamento da DPI associada a AR. Contudo, alguns fármacos imunossupressores têm demonstrado resultados promissores, bem como os fármacos antifibróticos aprovados para o tratamento da fibrose pulmonar idiopática (FPI).
Os fármacos imunossupressores são comumente utilizados no tratamento da DPI associada a AR, embora de forma menos consensual nos casos de doença fibrosante, nomeadamente perante um padrão de UIP.20,25,26 No caso dos glucocorticóides, estes foram durante muito tempo considerados os fármacos de primeira linha no tratamento da DPI associada a AR.20 Contudo, dado o vasto espetro de efeitos adversos associados ao seu uso, estes devem ser utilizados durante um curto período de tempo, nomeadamente no tratamento de exacerbações, ou quando é necessário um início rápido de ação20 . A dose inicial frequentemente prescrita é de 0.5-1mg/Kg/dia de prednisolona ou equivalente, embora em casos de doença rapidamente progressiva possam ser administrados pulsos intravenosos de metilprednisolona 1g/dia, durante 3 dias. 20 No sentido de minimizar os efeitos adversos dos glucocorticóides, estes são frequentemente associados a outros imunossupressores20, com vista a uma rápida redução da sua dose. Além disso, doentes com idade superior a 65 anos, sob terapêutica com glucocorticóides ou outros imunossupressores e com doença pulmonar coexistente têm um maior risco de infeção por Pneumocystis jirovecii27 , pelo que deve ser equacionada a realização de profilaxia com cotrimoxazol. Por outro lado, os doentes medicados com prednisolona > 5-7.5mg/dia ou equivalente por um período superior a 3 meses têm indicação para fazer profilaxia de osteoporose secundária.28
Dentro dos fármacos modificadores da doença sintéticos, alguns estudos de pequena dimensão demonstraram que o micofenolato de mofetil29,30 e a ciclofosfamida31,32 poderão ter algum papel na estabilização da DPI, embora a sua fraca eficácia no controlo da atividade articular implique a associação a outros fármacos modificadores da doença.33 Relativamente à azatioprina, esta demonstrou estabilizar a DPI34, e controlar a atividade articular20, embora com mais efeitos adversos, nomeadamente em relação ao micofenolato de mofetil.34,35
No que diz respeito aos fármacos biológicos, o rituximab (anticorpo antiCD20) é o que tem apresentado resultados mais promissores no tratamento da DPI 36,37, tendo como mais-valia ser também eficaz no controlo da atividade articular.20 Os resultados referentes aos inibidores do fator de necrose tumoral α e do tocilizumab (anticorpo anti recetor da interleucina-6) são contraditórios 26, embora os primeiros pareçam estar associados a uma maior mortalidade quando comparados com o rituximab.38 Ainda no âmbito dos fármacos biológicos, existem ainda poucos dados sobre o uso de abatacept (proteína de fusão que modula a co-estimulação das células T), embora os existentes tenham demonstrado estabilidade clínica e funcional dos doentes com DPI associada a AR.39 A informação referente aos inibidores da JAK é ainda inconclusiva.39 Os antifibróticos são uma classe de fármacos mais recente e que poderão ser cruciais no tratamento da DPI associada a AR. No caso do nintedanib, este está aprovado para o tratamento da FPI e de outras doenças pulmonares crónicas fibrosantes progressivas, nas quais se pode incluir a DPI associada a AR.39 Os resultados promissores deste fármaco foram evidenciados no ensaio de fase 3 INBUILD40, realizado em doentes com DPI fibrosante que não FPI (incluindo doentes com AR), e no qual os doentes tratados com nintedanib tiveram um menor declínio de capacidade vital forçada em relação ao placebo ao final de 52 semanas, sendo os resultados semelhantes entre os doentes com padrão UIP e outros padrões.
Por outro lado, a pirfenidona está aprovada para o tratamento da FPI tendo sido também estudada na DPI inclassificável, que pode incluir a DPI associada a AR.20 O uso da pirfenidona nos doentes com DPI associada a AR está neste momento a ser avaliado no ensaio de fase 2 TRAIL141, embora já existam alguns relatos de casos26 em que a sua utilização permitiu estabilizar a doença pulmonar. Com base na fisiopatologia da DPI associada a AR, que implica mecanismos inflamatórios e fibrosantes22, a combinação de fármacos imunossupressores e antifibróticos poderá constituir o pilar do tratamento desta patologia, conceito que está a ser avaliado na DPI associada à esclerose sistémica, através do ensaio Scleroderma Lung Study III.
Por fim, em situações de doença progressiva, refratária às várias opções terapêuticas, poderá ainda ser considerado o transplante pulmonar, sendo que de acordo com a literatura, a sobrevida destes doentes ao final de um ano pós-transplante é sobreponível à dos doentes transplantados por FPI.42
A DPI associada a AR é a segunda causa de mortalidade nos doentes com AR, sendo apenas precedida pelas causas cardiovasculares22, com uma sobrevida média de 5-8 anos. 26
De acordo com a literatura, o género masculino, a idade tardia, uma capacidade de difusão do monóxido de carbono baixa, a extensão da fibrose e a presença de um padrão de UIP estão associados a uma maior mortalidade.43 No caso específico dos doentes com padrão de UIP, o prognóstico é semelhante ao dos doentes com FPI.44
As pneumonias intersticiais idiopáticas (PII) são um grupo de doenças intersticiais pulmonares que partilham características clínicas, radiológicas e histopatológicas, sendo requerida a exclusão de causa identificável de pneumonia intersticial, como exposições ambientais, toxicidade medicamentosa ou doença do tecido conjuntivo (DTC), para o seu diagnóstico.45
No entanto, vários estudos demonstraram que alguns pacientes diagnosticados com PII apresentam características que sugerem um processo autoimune subjacente, sem, no entanto, serem suficientes para preencherem os critérios de diagnóstico de DTC. Estes pacientes têm sido descritos na literatura sob diversas nomenclaturas, incluindo “undifferentiated CTD associated ILD (UCTDILD)”, “lung-dominant CTD” ou “autoimmune-featured ILD”, com critérios de diagnóstico diferentes e populações heterogéneas, o que dificultou a realização de estudos prospetivos com intuito de clarificar os atributos clínicos, fisiopatológicos e prognósticos deste grupo de indivíduos, bem como a sua melhor abordagem terapêutica.
Neste sentido, em 2015 uma task force da European Respiratory Society conjuntamente com a American Thoracic Society propôs o termo pneumonia intersticial com características autoimunes (IPAF), com vista a uniformizar a designação deste grupo de doentes na literatura. Adicionalmente, sugeriu critérios diagnósticos para incluir doentes nesta categoria, com intuito de homogeneizar a população assim identificada, o que facilitaria a prossecução de estudos prospetivos para uma caracterização mais esclarecida desta entidade.46
Os autores ressalvam que esta é uma plataforma em desenvolvimento cujo intuito é promover a investigação nesta área e não servir de guidelines para a prática clínica.46
Os critérios propostos pela task force da European Respiratory Society conjuntamente com a American Thoracic Society encontram-se explicitados na Tabela 1 e são atualmente usados na identificação da população-alvo, isto é, no reconhecimento de doentes com pneumonia intersticial sem causa identificada, mas com características que sugerem um processo autoimune subjacente.46
Para que o paciente assim seja classificado, deve ter evidência de pneumonia intersticial em TC tórax de alta resolução (TCAR), para a qual não existe uma etiologia definida, e não preencher os critérios de uma doença do tecido conjuntivo (DTC). A estes requisitos deve associar a presença de pelo menos uma característica de dois dos três domínios: clínico, serológico e morfológico.
Alguma discussão tem surgido na literatura após a publicação destes critérios, nomeadamente pela inclusão de aspetos clínicos mais específicos de DTC o que permite o envolvimento de formas iniciais destas doenças, como esclerose sistémica ou miopatias inflamatórias, para as quais a abordagem terapêutica será substancialmente diferente. Por outro lado, algumas características clínicas não incluídas nos critérios apresentaram-se como relativamente frequentes nas revisões sistemáticas de estudos retrospetivos, como a síndrome sicca.47
Também no domínio serológico, o aspeto mais contestado terá sido a não inclusão dos autoanticorpos anti-citoplasma de neutrófilo (ANCA), reconhecidamente associados a pneumonias intersticiais, mas que os autores entenderam não incluir por se relacionarem preferencialmente com vasculites e não com DTCs.46,47
No domínio morfológico, a exclusão do padrão de pneumonia intersticial usual (UIP) radiológico e/ou histológico mereceu igualmente alguma contestação.
Os autores do statement sustentam a sua opinião no facto deste padrão não predispor a uma maior probabilidade de doença autoimune. Contudo, vários estudos apontam para uma percentagem significativa de doentes com padrão UIP e que este aspecto poderá ser condicionador de prognóstico.48,49
De forma consensual, todos os diferentes autores referem, no entanto, que apenas a realização de estudos prospetivos de larga escala permitirá desfazer algumas dúvidas e aferir de forma mais apurada estes critérios.
Tabela 1: Critérios de classificação de pneumonia intersticial com características autoimunes
- Presença de pneumonia intersticial (por TCAR ou biopsia cirúrgica) e,
- Exclusão de etiologias alternativas e,
- Não completar critérios para uma doença do tecido conjuntivo definida e,
- Pelo menos uma característica de pelo menos dois destes domínios:
- Domínio clínico
- Domínio serológico
- Domínio morfológico
- Domínio Clínico
- Fissuras digitais distais (“mãos de mecânico”)
- Ulcerações digitais distais
- Artrite inflamatória ou rigidez poliarticular matinal ≥ 60 min
- Telangiectasias palmares
- Fenómeno de Raynaud
- Edema digital inexplicado
- Rash fixo na superfície extensora dos dedos (“sinal de Gottron”)
- Domínio serológico
- ANA título ≥1:320, padrão difuso, mosqueado, homogéneo ou
- ANA padrão nucleolar (qualquer título) ou
- ANA padrão centrómero (qualquer título)
- Fator reumatoide ≥2x limite superior de referência
- Anti-CCP
- Anti-dsDNA
- Anti-Ro (SS-A)
- Anti-La (SS-B)
- Anti-ribonucleoproteína
- Anti-Smith
- Anti-topoisomerase (Scl-70)
- Anti-tRNA sintetase (ex. Jo-1, PL-7, PL-12; outros: EJ, OJ, KS, Zo, tRS)
- Anti-PM-Scl
- Anti-MDA-5
- Domínio morfológico
- Padrões radiológicos sugestivos por TCAR
- NSIP
- PO
- Sobreposição NSIP/PO
- LIP
- Padrões ou atributos histopatológicos por biopsia cirúrgica
- NSIP
- PO
- Sobreposição NSIP/PO
- LIP
- Agregados linfoides intersticiais com centros germinativos
- Infiltração linfoplasmocitária difusa (com ou sem folículos linfoides)
- Envolvimento multi-compartimental (em adição à pneumonia intersticial):
- Derrame ou espessamento pleural inexplicado
- Derrame ou espessamento pericárdico inexplicado
- Doença da via aérea intrínseca inexplicada# (por PFV, imagiologia ou patologia)
- Vasculopatia pulmonar inexplicada
TCAR: TC torácica de alta resolução; ANA: anticorpo anti-nuclear; NSIP: pneumonia intersticial não específica; PO: pneumonia organizativa; LIP: pneumonia intersticial linfocítica; PFV: provas de função ventilatória; #: inclui obstrução do fluxo aéreo, bronquiolite ou bronquiectasias
Não existem estudos epidemiológicos que permitam retirar conclusões referentes às pneumonias intersticiais com características autoimunes (IPAF). Apenas se podem colher alguns dados baseados em estudos retrospetivos, com evidentes limitações e viés de recolha.
A proporção de doentes com IPAF dentro de cada população estudada rondou os 15 a 20% do total de pacientes, embora este dado não seja referido de forma regular em todas as publicações.
Em meta-análises recentes, a média etária destes doentes parece situar-se na sexta década de vida, variando entre 53.2 e 67.9 anos, consoante as séries. A proporção de homens distribuiu-se nos estudos de maior escala entre 23.5 e 59.4%, tendo contribuído para tal variabilidade a amostra onde foram colhidos os dados (por exemplo, populações com doenças fibróticas ou com positividade para certos autoanticorpos). A história de tabagismo (prévio/atual) também apresentou uma variabilidade significativa, com valores entre os 19.2 e os 56.2%.47,50
A distribuição de pacientes pelos diferentes domínios da classificação das IPAF denota uma maior percentagem dos domínios serológico e morfológico em todas as séries, sendo o domínio clínico o que demostra maior variabilidade. A presença do padrão de pneumonia intersticial usual (UIP), não incluída nos critérios morfológicos, mas potencialmente um fator prognóstico, é extremamente variável na literatura, com valores entre 0 e 73.8%, a maioria situando-se entre os 30 e os 50%.50
Na comparação da mortalidade por todas as causas, os resultados são, uma vez mais, díspares, observando-se nalgumas séries uma menor mortalidade dos doentes IPAF versus fibrose pulmonar idiopática (FPI) com significância estatística51, não corroborada noutras séries, particularmente quando se comparava o grupo IPAF-UIP com FPI.23,27,28 Em relação às DTC, também se verificou ausência de significância estatística na comparação com IPAF na maioria dos estudos51,54, embora num estudo de maior dimensão esta diferença tenha sido significativa a favor das DTC, ou seja, os doentes com IPAF teriam pior prognóstico que os doentes com DTC.48
A idade parece ser o único fator prognóstico com validade em análises uni ou multivariadas dos diferentes estudos. No entanto, outros parâmetros como o sexo masculino, a história de tabagismo, o padrão UIP ou a função ventilatória (avaliada pela capacidade vital forçada - FVC - ou pela capacidade de difusão pelo monóxido de carbono - DLCO) parecem ser potenciais fatores prognósticos, carecendo de estudos prospetivos de maior dimensão para sua confirmação. 50
Estes dados ressaltam a heterogeneidade de populações estudadas, apesar da tentativa de uniformização pela aplicação dos critérios de classificação das IPAF.
Não existem recomendações internacionais na abordagem terapêutica deste grupo de doentes nem qualquer tipo de ensaio randomizado ou estudos casocontrolo que permitam aferir a eficácia ou segurança dos diferentes agentes farmacêuticos. Sendo que os estudos referentes à IPAF são retrospetivos na sua natureza, apenas contamos com a descrição da terapêutica efetuada nalguns deles e apenas num estudo este item é valorizado em termos de análise uni variada de prognóstico, não tendo apresentado um hazard ratio estatisticamente significativo para as diferentes modalidades terapêuticas (corticoterapia +/- imunossupressores).52
Destes estudos, retira-se que a maioria dos doentes foi submetido a tratamento com corticosteroides, muitas vezes em complemento com outro imunossupressor [micofenolato mofetil (MMF), ciclofosfamida, azatioprina, tacrolimus ou rituximab], havendo alguns casos de terapêutica com anti fibróticos (maioritariamente, pirfenidona).
Fischer et al. incluiu 19 pacientes com IPAF num estudo de 125 pacientes com DPI-DTC, tendo verificado uma melhoria da FVC em todos os doentes, embora sem significância estatística nos doentes com IPAF.30 Também no trabalho de McCoy et al., 24 doentes com IPAF foram expostos a MMF, na maioria em adição a corticosteroides (89%), versus 28 não expostos, não tendo havido diferenças estatisticamente significativas na variação da FVC e da DLCO, mas apenas uma tendência para um menor declínio destes parâmetros no grupo exposto.56
Wiertz et al. avaliou a resposta à administração por pulsos de ciclofosfamida em 13 doentes com IPAF tendo verificado uma resposta favorável estatisticamente significativa, efeito esse que se prolongou pelos 12 meses de avaliação, pese embora todos os doentes tenham efetuado terapêutica de consolidação com corticosteroides e outros imunossupressores.57
Uma série alargada de utilização de rituximab na doença intersticial refratária incluiu 9 pacientes com IPAF, todos tratados previamente com MMF + corticosteroides. Dos 5 doentes em que foi possível fazer uma avaliação funcional pré e pós-tratamento, 4 estabilizaram ou melhoraram e 1 faleceu.58
Claramente são necessários ensaios randomizados prospetivos com vista a comprovar o benefício destes fármacos, frequentemente usados no âmbito das DTC.
Na ausência de recomendações internacionais, uma abordagem razoável será agir de acordo com o pressuposto para as restantes doenças intersticiais, ajustado ao comportamento da doença. Assim, sugere-se a realização de TCAR à altura do diagnóstico e quando se deseje avaliar uma resposta terapêutica ou um agravamento sintomático ou funcional.
As PFV poderão ser mais informativas como forma de monitorizar a evolução da doença pelos dados que retiramos de outras doenças intersticiais, nomeadamente de outras PII como a FPI ou a NSIP idiopática. Nestas, a avaliação seriada da FVC e da DLCO permite identificar doentes em maior risco de mortalidade pelo declínio de 10% ou 15%, respetivamente. Neste contexto, é habitual repetir PFV a cada 3-6 meses para monitorizar as alterações da função pulmonar.
No âmbito das IPAF, será ainda importante monitorizar o surgimento de novos dados clínicos que possam levar a um diagnóstico de DTC. Embora não sendo um dado consensual na literatura, alguns estudos reportam cerca de 10 a 15% de doentes que desenvolveram uma DTC definida no período de follow-up.52,59
As miopatias inflamatórias, que incluem a poliomiosite e a dermatomiosite, são um grupo de doenças raras, que apresentam além da típica fraqueza muscular proximal, um amplo espetro de manifestações extra-musculares, nomeadamente DPI. A DPI está descrita em 19.9-86% dos doentes com miopatias inflamatórias60, sendo o padrão de OP o mais característico. Contudo, o padrão mais frequentemente reportado é do PII.60 Além disso, muitos destes doentes apresentam envolvimento dos músculos respiratórios, o que muitas vezes agrava a restrição subjacente à DPI. Nas miopatias inflamatórias o perfil imunológico assume particular importância, dado que a presença dos anticorpos anti-MDA5/anti-CADM-140 e anti sintetase (nos quais se incluem o anticorpo anti-Jo1) está associada a um maior risco de DPI.60
A Síndrome de Sjögren afeta preferencialmente as glândulas exócrinas, sendo as queixas de xeroftalmia e xerostomia as mais frequentemente reportadas. Além disso muitos doentes com esta patologia referem tosse seca, que pode ser uma manifestação de xerotraqueia ou de DPI subjacente. No que diz respeito aos padrões de DPI, apesar do padrão de PIL ser o mais caraterístico, é o padrão de PII o mais prevalente, estando descrito em 45% dos doentes.60
O lúpus eritematoso sistémico é uma doença heterogénea, com atingimento multiorgânico. O envolvimento pulmonar ocorre essencialmente sob a forma de serosite, embora em 3-11% dos doentes possa surgir DPI, sendo o padrão de PII o mais prevalente.60
1. Van den Hoogen F, Khanna D, Fransen J, et al. 2013 classification criteria for systemic sclerosis: an American College of Rheumatology/European League against Rheumatism collaborative initiative. Arthritis Rheum 2013; 65: 2737-47.
2. Ferri C, Valentini G, Cozzi F, et al. Systemic sclerosis: demographic, clinical, and serologic features and survival in 1,012 Italian patients. Medicine (Baltimore) 2002; 81:139.
3. Van Bom L, Affandi AJ, Broen J, et al. Proteome-wide analysis and CXCL4 as a biomarker in systemic sclerosis. N Engl J Med 2014; 370:433.
4. Tyndall, A J; Bannert, B; Vonk, M; et al. “Causes and risk factors for death in systemic sclerosis: a study from the EULAR Scleroderma Trials and Research (EUSTAR) database”. Annals of the Rheumatic Diseases 2010, 69(10):1809-1815.
5. Bouros D, Wells AU, Nicholson AG, et al.. “Histopathologic subsets of fibrosing alveolitis in patients with systemic sclerosis and their relationship to outcome.” Am J Respir Crit Care Med. 2002 Jun 15;165(12):1581-6.
6. Ha YJ, Lee YJ, Kang EH. “Lung involvements in Rheumatic Diseases: Update on the epidemiology, pathogenesis, clinical features and treatment.” Biomed Res Int. 2018:6930297.
7. Perelas A, Silver R, Arrossi A, et al. Systemic Sclerosis-associated interstitial lung disease. Lancet 2020; vol 8, Issue 3: 304:320
8. Gilson M, Zerkak D, Wipff J, et al. Prognostic factors for lung function in systemic sclerosis: prospective study of 105 cases. Eur Respir J 2010; 35:112.
9. Khanna D, Gladue H, Channick R, et al. Recommendations for screening and detection of connective tissue disease-associated pulmonary arterial hypertension. Arthritis Rheum 2013; 65:3194.
10. Suliman YA, Dobrota R, Huscher D, et al. Brief Report: Pulmonary Function Tests: High Rate of False-Negative Results in the Early Detection and Screening of Scleroderma-Related Interstitial Lung Disease. Arthritis Rheumatol 2015; 67:3256.
11. Hoffmann-Vold AM, Aaløkken TM, Lund MB, et al. Predictive value of serial high-resolution computed tomography analyses and concurrent lung function tests in systemic sclerosis. Arthritis Rheumatol 2015; 67:2205.
12. Walker UA, Tyndall A, Czirják L, et al. “Clinical risk assessment of organ manifestations in systemic sclerosis: a report from the EULAR Scleroderma Trials and Research group database.” Annals of the Rheumatic Diseases 2007; 66:754-763.
13. Goh NS, Desai SR, Veeraraghavan S, et al. “Interstitial lung disease in systemic sclerosis: a simple staging system.” Am J Respir Crit Care Med. 2008 Jun 1;177(11):1248-54.
14. Tashkin DP, Roth MD, Clements PJ, et al. Mycophenolate mofetil versus oral cyclophosphamide in scleroderma-related interstitial lung disease (SLS II): a randomised controlled, double-blind, parallel group trial. Lancet Respir Med. 2016 Sep;4(9):708-719.
15. Tashkin DP, Elashoff R, Clements PJ, et al. Cyclophosphamide versus Placebo in Scleroderma Lung Disease N Engl J Med 2006; 354:2655-66.
16. Hoyles RK, Ellis RW, Wellsbury J, et al. A multicenter, prospective, randomized, double-blind, placebo-controlled trial of corticosteroids and intravenous cyclophosphamide followed by oral azathioprine for the treatment of pulmonary fibrosis in scleroderma. Arthritis Rheum. 2006 Dec;54(12):3962-70.
17. Distler O. Highland KB, Gahlemann M, et al. Nintedanib for Systemic Sclerosis- Associated Interstitial Lung Disease. N Engl J Med 2019; 380: 2518-28.
18. Rubio-Rivas M, Royo C, Simeón CP, et al.Mortality and survival in systemic sclerosis: systematic review and meta-analysis. Semin Arthritis Rheum 2014; 44: 208-219.
19. Tyndall AJ, Bannert B, Vonk M, et al. Causes and risk factors for death in systemic sclerosis: a study from the EULAR Scleroderma Trials and Research (EUSTAR) database. Ann Rheum Dis 2010; 69: 1809-15.
20. Huang S, Kronzer VL, Dellaripa PF, Deane K, Bolster M, Nagaraja V, et al. Rheumatoid Arthritis-Associated Interstitial Lung Disease: Current Update on Prevalence, Risk Factors, and Pharmacologic Treatment. Current Treatment Options in Rheumatology. 2020;
21. Gizinski AM, Mascolo M, Loucks JL, Kervitsky A, Meehan RT, Brown KK, et al. Rheumatoid arthritis (RA)-specific autoantibodies in patients with interstitial lung disease and absence of clinically apparent articular RA. Clin Rheumatol. 2009 May;28(5):611-3.
22. Shaw M, Collins BF, Ho LA, Raghu G. Rheumatoid arthritis-associated lung disease. European Respiratory Review. 2015 Mar 1;24(135):1-16.
23. Kiely P, Busby AD, Nikiphorou E, Sullivan K, Walsh DA, Creamer P, et al. Is incident rheumatoid arthritis interstitial lung disease associated with methotrexate treatment? Results from a multivariate analysis in the ERAS and ERAN inception cohorts. BMJ Open. 2019 05;9(5):e028466.
24. Hallowell RW, Horton MR. Interstitial lung disease in patients with rheumatoid arthritis: spontaneous and drug induced. Drugs. 2014 Mar;74(4):443-50.
25. O’Dwyer DN, Armstrong ME, Cooke G, Dodd JD, Veale DJ, Donnelly SC. Rheumatoid Arthritis (RA) associated interstitial lung disease (ILD). Eur J Intern Med. 2013 Oct;24(7):597-603.
26. Cassone G, Manfredi A, Vacchi C, Luppi F, Coppi F, Salvarani C, et al. Treatment of Rheumatoid Arthritis-Associated Interstitial Lung Disease: Lights and Shadows. J Clin Med. 2020 Apr 10;9(4).
27. Yukawa K, Nagamoto Y, Watanabe H, Funaki M, Iwahashi M, Yamana J, et al. Risk Factors for Pneumocystis jirovecii Pneumonia in Patients With Rheumatoid Arthritis and a Prophylactic Indication of Trimethoprim/Sulfamethoxazole. J Clin Rheumatol. 2018 Oct;24(7):355-60.
28. Compston J. Glucocorticoid-induced osteoporosis: an update. Endocrine. 2018;61(1):7-16.
29. Saketkoo LA, Espinoza LR. Experience of mycophenolate mofetil in 10 patients with autoimmune-related interstitial lung disease demonstrates promising effects. Am J Med Sci. 2009 May;337(5):329-35.
30. Fischer A, Brown KK, Du Bois RM, Frankel SK, Cosgrove GP, Fernandez-Perez ER, et al. Mycophenolate mofetil improves lung function in connective tissue disease-associated interstitial lung disease. J Rheumatol. 2013 May;40(5):640-6.
31. Schupp JC, Köhler T, Müller-Quernheim J. Usefulness of Cyclophosphamide Pulse Therapy in Interstitial Lung Diseases. Respiration. 2016;91(4):296-301.
32. Fu Q, Wang L, Li L, Li Y, Liu R, Zheng Y. Risk factors for progression and prognosis of rheumatoid arthritis-associated interstitial lung disease: single center study with a large sample of Chinese population. Clin Rheumatol. 2019 Apr;38(4):1109-16.
33. Kelly C, Saravanan V. Treatment strategies for a rheumatoid arthritis patient with interstitial lung disease. Expert Opin Pharmacother. 2008 Dec;9(18):3221-30.
34. Oldham JM, Lee C, Valenzi E, Witt LJ, Adegunsoye A, Hsu S, et al. Azathioprine response in patients with fibrotic connective tissue disease-associated interstitial lung disease. Respir Med. 2016;121:117-22.
34. Oldham JM, Lee C, Valenzi E, Witt LJ, Adegunsoye A, Hsu S, et al. Azathioprine response in patients with fibrotic connective tissue disease-associated interstitial lung disease. Respir Med. 2016;121:117-22.
35. Kelly C, Young A, Ahmad Y, Dawson J, Carty S, Nisar M, et al. 092 The Effect of Steroids, Azathioprine and Mycophenolate on the Risk of Death in Rheumatoid Lung Disease. Rheumatology (Oxford). 2016 Apr 1;55(suppl_1):i99-100.
36. Md Yusof MY, Kabia A, Darby M, Lettieri G, Beirne P, Vital EM, et al. Effect of rituximab on the progression of rheumatoid arthritis-related interstitial lung disease: 10 years’ experience at a single centre. Rheumatology (Oxford). 2017 Aug;56(8):1348-57.
37. Duarte AC, Porter JC, Leandro MJ. The lung in a cohort of rheumatoid arthritis patients-an overview of different types of involvement and treatment. Rheumatology (Oxford). 2019 May 14;
38. Druce KL, Iqbal K, Watson KD, Symmons DPM, Hyrich KL, Kelly C. Mortality in patients with interstitial lung disease treated with rituximab or TNFi as a first biologic. RMD Open [Internet]. 2017 Jul 13 [cited 2019 Jan 26];3(1). Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5604605/
39. Fernández-Díaz C, Loricera J, Castañeda S, López-Mejías R, Ojeda-García C, Olivé A, et al. Abatacept in patients with rheumatoid arthritis and interstitial lung disease: A national multicenter study of 63 patients. Semin Arthritis Rheum. 2018;48(1):22-7.
40. Flaherty KR, Wells AU, Cottin V, Devaraj A, Walsh SLF, Inoue Y, et al. Nintedanib in Progressive Fibrosing Interstitial Lung Diseases. N Engl J Med. 2019 31;381(18):1718-27.
41. Solomon JJ, Danoff SK, Goldberg HJ, Woodhead F, Kolb M, Chambers DC, et al. The Design and Rationale of the Trail1 Trial: A Randomized Double-Blind Phase 2 Clinical Trial of Pirfenidone in Rheumatoid Arthritis-Associated Interstitial Lung Disease. Adv Ther. 2019;36(11):3279-87.
42. Yazdani A, Singer LG, Strand V, Gelber AC, Williams L, Mittoo S. Survival and quality of life in rheumatoid arthritis-associated interstitial lung disease after lung transplantation. J Heart Lung Transplant. 2014 May;33(5):514-20.
43. Assayag D, Lubin M, Lee JS, King TE, Collard HR, Ryerson CJ. Predictors of mortality in rheumatoid arthritis-related interstitial lung disease. Respirology. 2014 May;19(4):493-500.
44. Kim EJ, Elicker BM, Maldonado F, Webb WR, Ryu JH, Van Uden JH, et al. Usual interstitial pneumonia in rheumatoid arthritis-associated interstitial lung disease. European Respiratory Journal. 2010 Jun 1;35(6):1322-8.
45. Travis WD, Costabel U, Hansell DM, King TE Jr, Lynch DA, Nicholson AG, Ryerson CJ, Ryu JH, Selman M, Wells AU, Behr J, Bouros D, Brown KK, Colby TV, Collard HR, Cordeiro CR, Cottin V, Crestani B, Drent M, Dudden RF, Egan J, Flaherty K, Hogaboam C, Inoue Y, Johkoh T, Kim DS, Kitaichi M, Loyd J, Martinez FJ, Myers J, Protzko S, Raghu G, Richeldi L, Sverzellati N, Swigris J, Valeyre D; ATS/ERS Committee on Idiopathic Interstitial Pneumonias. An official American Thoracic Society/European Respiratory Society statement: Update of the international multidisciplinary classification of the idiopathic interstitial pneumonias. Am J Respir Crit Care Med. 2013 Sep 15;188(6):733-48.
46. Fischer A, Antoniou KM, Brown KK, Cadranel J, Corte TJ, du Bois RM, Lee JS, Leslie KO, Lynch DA, Matteson EL, Mosca M, Noth I, Richeldi L, Strek ME, Swigris JJ, Wells AU, West SG, Collard HR, Cottin V; “ERS/ATS Task Force on Undifferentiated Forms of CTD-ILD”. An official European Respiratory Society/ American Thoracic Society research statement: interstitial pneumonia with autoimmune features. Eur Respir J. 2015 Oct;46(4):976-87.
47. Sambataro G, Sambataro D, Torrisi SE, et al. State of the art in interstitial pneumonia with autoimmune features: a systematic review on retrospective studies and suggestions for further advances. European Respiratory Review Jun 2018; 7 (148): 170139.
48. Oldham JM, Adegunsoye A, Valenzi E, Lee C, Witt L, Chen L, Husain AN, Montner S, Chung JH, Cottin V, Fischer A, Noth I, Vij R, Strek ME. Characterisation of patients with interstitial pneumonia with autoimmune features. Eur Respir J. 2016 Jun;47(6):1767-75. Erratum in: Eur Respir J. 2017 May 11;49(5): PMID: 27103387; PMCID: PMC5515625.
49. Collins BF, Spiekerman CF, Shaw MA, Ho LA, Hayes J, Spada CA, Stamato CM, Raghu G. Idiopathic Interstitial Pneumonia Associated With Autoantibodies: A Large Case Series Followed Over 1 Year. Chest. 2017 Jul;152(1):103-112.
50. Kamiya H, Panlaqui OM. Systematic review and meta-analysis of the prognosis and prognostic factors of interstitial pneumonia with autoimmune features. BMJ Open. 2019 Dec 11;9(12):e031444.
51. Lim JU, Gil BM, Kang HS, Oh J, Kim YH, Kwon SS. Interstitial pneumonia with autoimmune features show better survival and less exacerbations compared to idiopathic pulmonary fibrosis. BMC Pulm Med. 2019 Jul 4;19(1):120.
52. Kim HC, Lee JH, Chae EJ, Song JS, Song JW. Long-term clinical course and outcome of interstitial pneumonia with autoimmune features. Respirology. 2020 Jun;25(6):636-643.
53. Yoshimura K, Kono M, Enomoto Y, Nishimoto K, Oyama Y, Yasui H, Hozumi H, Karayama M, Suzuki Y, Furuhashi K, Enomoto N, Fujisawa T, Nakamura Y, Inui N, Sumikawa H, Johkoh T, Colby TV, Sugimura H, Suda T. Distinctive characteristics and prognostic significance of interstitial pneumonia with autoimmune features in patients with chronic fibrosing interstitial pneumonia. Respir Med. 2018 Apr; 137: 167-175.
54. Mejía M, Herrera-Bringas D, Pérez-Román DI, Rivero H, Mateos-Toledo H, Castorena-García P, Figueroa JE, Rojas-Serrano J. Interstitial lung disease and myositis-specific and associated autoantibodies: Clinical manifestations, survival and the performance of the new ATS/ERS criteria for interstitial pneumonia with autoimmune features (IPAF). Respir Med. 2017 Feb;123: 79-86.
55. Fischer A, Brown KK, Du Bois RM, Frankel SK, Cosgrove GP, Fernandez-Perez ER, Huie TJ, Krishnamoorthy M, Meehan RT, Olson AL, Solomon JJ, Swigris JJ. Mycophenolate mofetil improves lung function in connective tissue disease-associated interstitial lung disease. J Rheumatol. 2013 May;40(5):640-6.
56. McCoy SS, Mukadam Z, Meyer KC, Kanne JP, Meyer CA, Martin MD, Sampene E, Aesif SW, Rice LN, Bartels CM. Mycophenolate therapy in interstitial pneumonia with autoimmune features: a cohort study. Ther Clin Risk Manag. 2018 Nov 1;14: 2171-2181.
57. Wiertz IA, van Moorsel CHM, Vorselaars ADM, Quanjel MJR, Grutters JC. Cyclophosphamide in steroid refractory unclassifiable idiopathic interstitial pneumonia and interstitial pneumonia with autoimmune features (IPAF). Eur Respir J. 2018 Apr 19;51(4):1702519.
58. Keir GJ, Maher TM, Ming D, Abdullah R, de Lauretis A, Wickremasinghe M, Nicholson AG, Hansell DM, Wells AU, Renzoni EA. Rituximab in severe, treatment-refractory interstitial lung disease. Respirology. 2014 Apr;19(3):353-9.
59. Ito Y, Arita M, Kumagai S, Takei R, Noyama M, Tokioka F, Nishimura K, Koyama T, Notohara K, Ishida T. Serological and morphological prognostic factors in patients with interstitial pneumonia with autoimmune features. BMC Pulm Med. 2017 Aug 14;17(1):111.
60. Atzeni F, Gerardi MC, Barilaro G, Masala IF, Benucci M, Sarzi-Puttini P. Interstitial lung disease in systemic autoimmune rheumatic diseases: a comprehensive review. Expert Review of Clinical Immunology. 2018 Jan 2;14(1):69-82.

-
Pneumologistas
Serviço de Pneumologia Centro Hospitalar Vila Nova de Gaia/Espinho (CHVNG/E) Vila Nova de Gaia

A pneumonite de hipersensibilidade (PH) é uma patologia imunomediada que se manifesta por uma doença pulmonar intersticial (DPI) em indivíduos suscetíveis após exposição a um fator identificado ou desconhecido. Historicamente foi denominada de alveolite alérgica extrínseca e classificada em aguda, subaguda e crónica. Essas terminologia e classificação foram, entretanto, abandonadas e, num artigo recente de consenso da ATS/ALAT/JRS, foi adotada a denominação de pneumonite de hipersensibilidade.1 É uma entidade com várias formas de apresentação e fenótipos, constituindo em muitas situações um desafio diagnóstico, particularmente no diagnóstico diferencial com fibrose pulmonar idiopática. Apesar dos recentes avanços no diagnóstico, abordagem e tratamento, persistem muitas dúvidas relativamente à epidemiologia, patogénese e correta abordagem diagnóstica.1,2
A informação existente relativamente à epidemiologia é limitada, por ausência de critérios consensuais de diagnóstico e variabilidade de frequência entre países e dentro dos diferentes países. Essa variabilidade será explicada por diferenças regionais ambientais, ocupacionais e climáticas. Os dados epidemiológicos variam também de acordo com o tipo de estudo efetuado, se populacional ou do tipo coorte.3
Num estudo retrospetivo populacional realizado nos Estados Unidos da América (EUA) entre 2004 e 2013, baseado na análise de registos de duas seguradoras, a frequência de PH manteve-se relativamente estável ao longo do tempo, com a prevalência variando entre 1,67 e 2,71/100.000 ao ano, e a incidência 1,28 a 1,94/100.000 ao ano. A idade média foi de 52 anos e 58% dos casos eram mulheres. A prevalência aumentou com a idade, variando entre 0,65/100.000 (0-9 anos) e 11,2/100.000 (> 65 anos). Relativamente à apresentação da doença, 56-68% dos casos, a cada ano, foram classificados como crónicos.4 Num outro estudo retrospetivo com base numa coorte dinamarquesa de 6929 columbófilos, a HR ajustada para PH foi de 14,4 (IC 95%: 8,1-25,4) e para outras DPI 1,3 (IC 95%: 1,0-1,7).5
Num outro registo prospetivo na Índia, em 1084 novos doentes com DPI e após validação em reunião multidisciplinar, a PH constituiu 47% dos casos.6
Numa outra publicação com base em registos de três países europeus, a PH constituiu 4 a 15% de todos os casos de DPI.7
Uma interação complexa entre fatores genéticos, ambientais e outras caraterísticas do hospedeiro está na base do desenvolvimento e progressão de PH. Esta complexidade poderá explicar a razão pela qual, apesar da distribuição mundial de antigénios (Ag), apenas alguns indivíduos desenvolvem doença. Na patogenia desta entidade, verifica-se uma reação humoral e celular exagerada, envolvendo a imunidade inata e adquirida. Esta resposta é parcialmente explicada por uma função imunossupressora desadequada por parte das células reguladoras.1 Além da exposição a um Ag por um indivíduo geneticamente suscetível, parece que um second hit contribui para o desenvolvimento desta entidade. Vírus respiratórios, exposição a pesticidas e poluição (principalmente a presença na atmosfera de partículas em suspensão com diâmetros < 2,5 μm) poderão afetar a clearance de Ag, aumentar a capacidade dos macrófagos em apresentar Ag, aumentar a inflamação das vias aéreas, reduzir a clearance mucociliar e contribuir, assim, como cofatores no desenvolvimento desta entidade. Após inalação, o Ag é fagocitado por células apresentadoras de antigénio (macrófagos, células dendríticas) e acoplado a moléculas das moléculas de complexo de histocompatibilidade (MHC) II. O Ag é então reconhecido pelas células T CD4+, através do recetor da célula T. A diferenciação das células CD4+ no subtipo T helper 1 (Th1) é iniciado através da expressão do fator de transcrição T-bet, e citocinas como fator de necrose tumoral (TNF), interferão γ (IFN-γ) e IL-2. A progressão de sensibilização para PH, em indivíduos geneticamente suscetíveis, requer a acumulação pulmonar de linfócitos T CD4+ Th1, criando um microambiente pró-inflamatório. TNF e IFN-γ promovem a acumulação, ativação e agregação de macrófagos, resultando no desenvolvimento de um processo inflamatório granulomatoso. Por outro lado, a função supressora dos linfócitos T reguladores (Treg) é desadequada, levando a amplificação da resposta inflamatória. Treg expressam fator de transcrição FOXP3, CD25, e CTLA-4 na superfície celular. A redução da expressão de FOXP3 reduz a função supressiva Treg. Alguns estudos sugerem que Treg com expressão reduzida de FoxP3, tornam-se preferencialmente células Th2, mesmo num microambiente que favoreça Th1. O switch das células Th1 para Th2 favorece um fenótipo fibrótico.8
Uma resposta humoral dos linfócitos B contra o Ag também ocorre, levando a produção de anticorpos e formação de imunocomplexos (IC) Ag-anticorpo e ocorrendo também a sua ativação em plasmócitos. As citocinas IL-17 e IL-8 também presentes são poderosos quimiotáticos para recrutamento e ativação dos neutrófilos. Estes últimos apresentam recetores para a região constante da IgG, favorecendo ainda mais o seu recrutamento para o local da inflamação e interação com os IC. Esta resposta ocorre preferencialmente na forma não-fibrótica da PH, historicamente referida como a forma aguda e associada habitualmente a exposição intermitente e de alta intensidade ao Ag. Esta fase é mediada preferencialmente pela deposição de IC e com aumento franco de neutrófilos. Estes parecem estar implicados, principalmente numa fase inicial, com a resposta imunológica envolvendo a formação de granulomas. Esta fase poderá ser ainda reversível com a evicção de Ag, com ou sem tratamento com corticoterapia.
Os mecanismos e circunstâncias que conduzem a uma forma irreversível fibrótica da PH são ainda incertos. O risco de PH fibrótica aumenta com a idade, particularmente em indivíduos com mais de 65 anos. Os mecanismos associados ao envelhecimento não estão ainda esclarecidos, mas poderão estar associados ao encurtamento aberrante dos telómeros e a imunossenescência das células T.9
Na PH fibrótica, estudos sugerem a ocorrência de um switch da resposta celular Th1 para Th2, bem como apoptose epitelial aumentada e atividade fibroblástica anormal.9 Citocinas Th2, como a IL-4 e IL-13, estão associadas ao desenvolvimento de fibrose numa série de doenças crónicas inflamatórias. A inflamação crónica evolui para fibrose após expansão de fibroblastos. Estes diferenciam-se em miofibroblastos, que promovem a acumulação de matriz extracelular e destruição da arquitetura tecidular.
Apesar do risco de PH parecer ser menor nos fumadores, a PH fibrótica é mais frequente em fumadores.10 Num estudo retrospetivo de avaliação de prognóstico em doentes com PH confirmada histologicamente, doentes com padrão pneumonia intersticial usual (UIP) ou de pneumonia intersticial não-específica (NSIP) fibrótica eram predominantemente fumadores ou ex-fumadores.11
Alguns doentes apresentam também aspetos autoimunes, nomeadamente a presença de autoanticorpos como anticorpo antinucelares, antipeptídeos citrulinados cíclicos, anticorpos anti-DNA topoisomerase I (anti-Scl70), anticorpos contra o antigénio Ro (Anti-SS-A), anticorpos contra o antigénio La (Anti-SS-B) e fator reumatóide, aparentemente associados a um pior prognóstico.12
Os agentes incitantes são diversificados e variam de acordo com a região geográfica. A exposição pode ser ocupacional, doméstica ou recreativa. Mais de 200 antigénios foram descritos para a PH e a cada ano novas causas são referidas.1 Dividem-se em agentes predominantemente orgânicos (bactérias, fungos, proteínas animais ou vegetais e enzimas) e inorgânicos (químicos de baixo peso molecular ou metais) (Tabela 1). 13
Em muitos casos, a exposição não é identificada. A latência entre a exposição e o início da doença pode variar de meses a décadas, constituindo um desafio para o clínico detetar o tipo e origem do antigénio, principalmente em casos de exposição desconhecida e em baixa quantidade.
Alguns autores sugerem que um agente incitante poderá fazer parte de uma mistura de microrganismos, proteínas e outras matérias (por exemplo, pó). Uma outra teoria é que determinantes antigénicos (epítopos) comuns poderão resultar em hipersensibilidade a múltiplos agentes incitantes.
Uma revisão recentemente publicada sobre exposições e associação com fenótipos clínicos, identificou os pássaros (32% dos casos de PH em estudos baseados em registos) e o bolor (17% dos casos) como as exposições mais frequentemente reportadas. Os estudos revistos descrevem taxas de nãoidentificação do Ag entre 15 a 24%. Os casos em que não se identificou o Ag, estavam mais vezes associados a um padrão fibrótico.14
Tabela 1. Causas mais comuns de PH de acordo com o tipo de exposição.
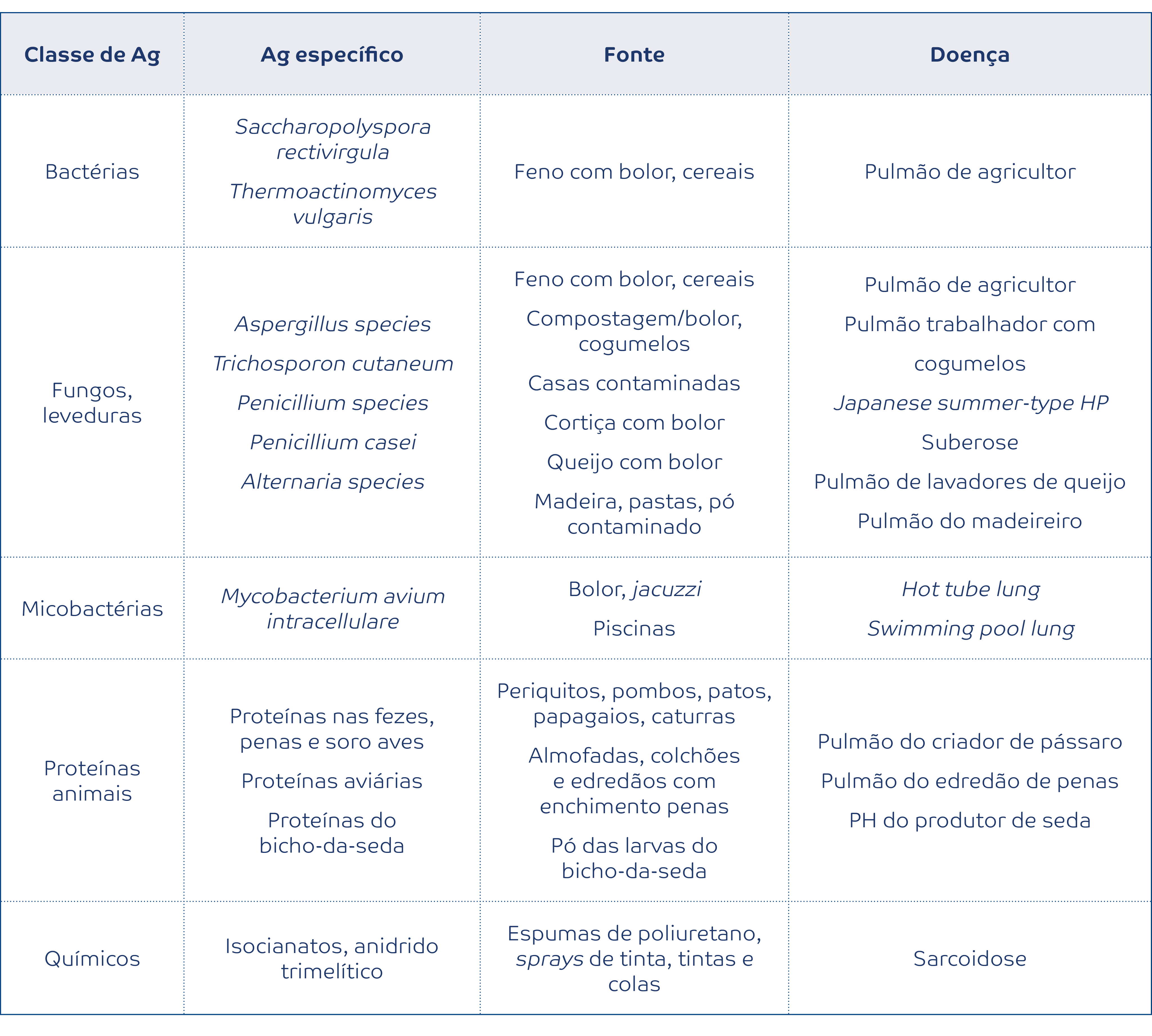
Adaptado de Spagnolo et al. J Investig Allergol Clin Immunol. 2015.
Historicamente, a pneumonite de hipersensibilidade era classificada como aguda, subaguda e crónica15 classificação esta amplamente criticada pelo facto de as suas categorias não serem bem demarcadas, e pela possibilidade de sobreposição destas categorias no mesmo doente. Tendo em conta que a presença imagiológica ou histopatológica de fibrose é o principal determinante prognóstico, a última guideline para o diagnóstico de pneumonite de hipersensibilidade no adulto sugere a categorização em PH fibrótica (puramente fibrótica ou caraterísticas mistas de inflamação e fibrose) ou não-fibrótica (puramente inflamatória).1
As caraterísticas radiológicas da PH traduzem o estadio histopatológico da doença. Desta forma, a mais recente guideline define as caraterísticas radiológicas atribuíveis a PH fibrótica e não-fibrótica, tendo em conta as alterações radiológicas descritas na literatura para cada subtipo e o impacto prognóstico das mesmas.1,16-23 Para cada um dos subtipos de PH, são estabelecidos critérios para os achados altamente sugestivos de PH (típico de PH), achados menos frequentemente reportados mas compatíveis com PH (compatível com PH) ou achados não sugestivos nem compatíveis com PH (indeterminado para PH). Estas caraterísticas encontram-se resumidas na tabela 2.
Tabela 2. Caraterísticas radiológicas (TCAR do tórax) do padrão de PH fibrótica.
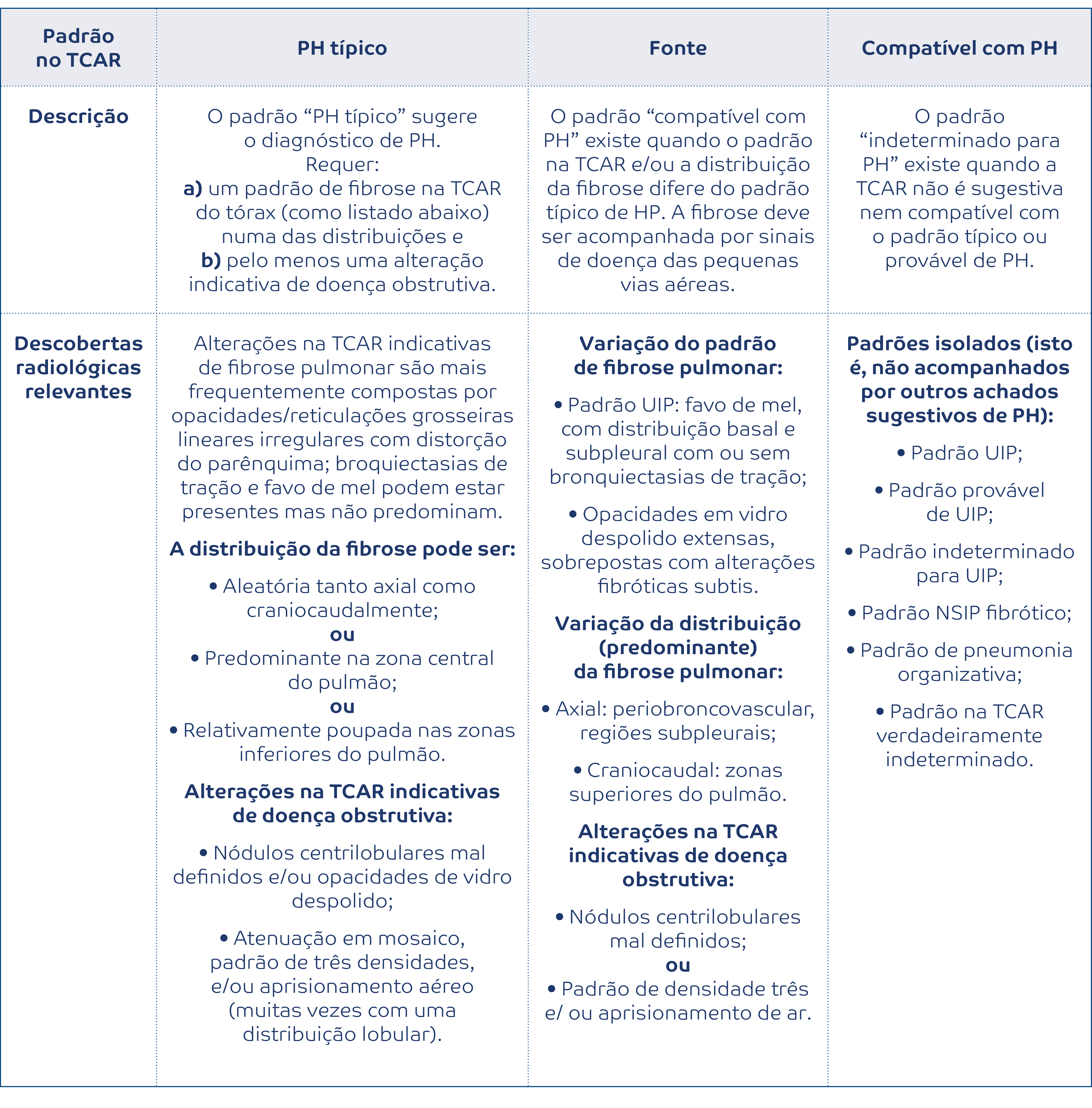
Caraterísticas radiológicas (TCAR do tórax) do padrão de PH fibrótica.
As caraterísticas histopatológicas típicas de PH
não-fibróticas consistem
em: bronquiolite crónica celular; infiltrado
inflamatório celular intersticial
bronquiolocêntrico; granunomas malformados e ausência de
caraterísticas
histopatológicas que sugiram um diagnóstico alternativo.
No entanto, nem
sempre todas as caraterísticas estão presentes. Na PH
fibrótica, à pneumonia
intersticial crónica subjacente acresce um padrão de
fibrose, por vezes
indistinguível das outras pneumonias intersticiais
idiopáticas como a fibrose
pulmonar idiopática ou a NSIP. Nestas situações, aspetos
como a polarização
brônquica das alterações histológicas ou fibrose em
ponte podem sugerir um
quadro de PH fibrótica.
A combinação das diferentes caraterísticas histológicas
observadas, tanto
para a PH não-fibrótica como para a PH fibrótica,
coloca-nos num cenário
histopatológico de PH definitiva, PH provável ou PH
indeterminada, de acordo
com a tabela 3.
Tabela 3. Critérios histopatológicos para o diagnóstico de PH (exceto Hot-Tub Lung*)

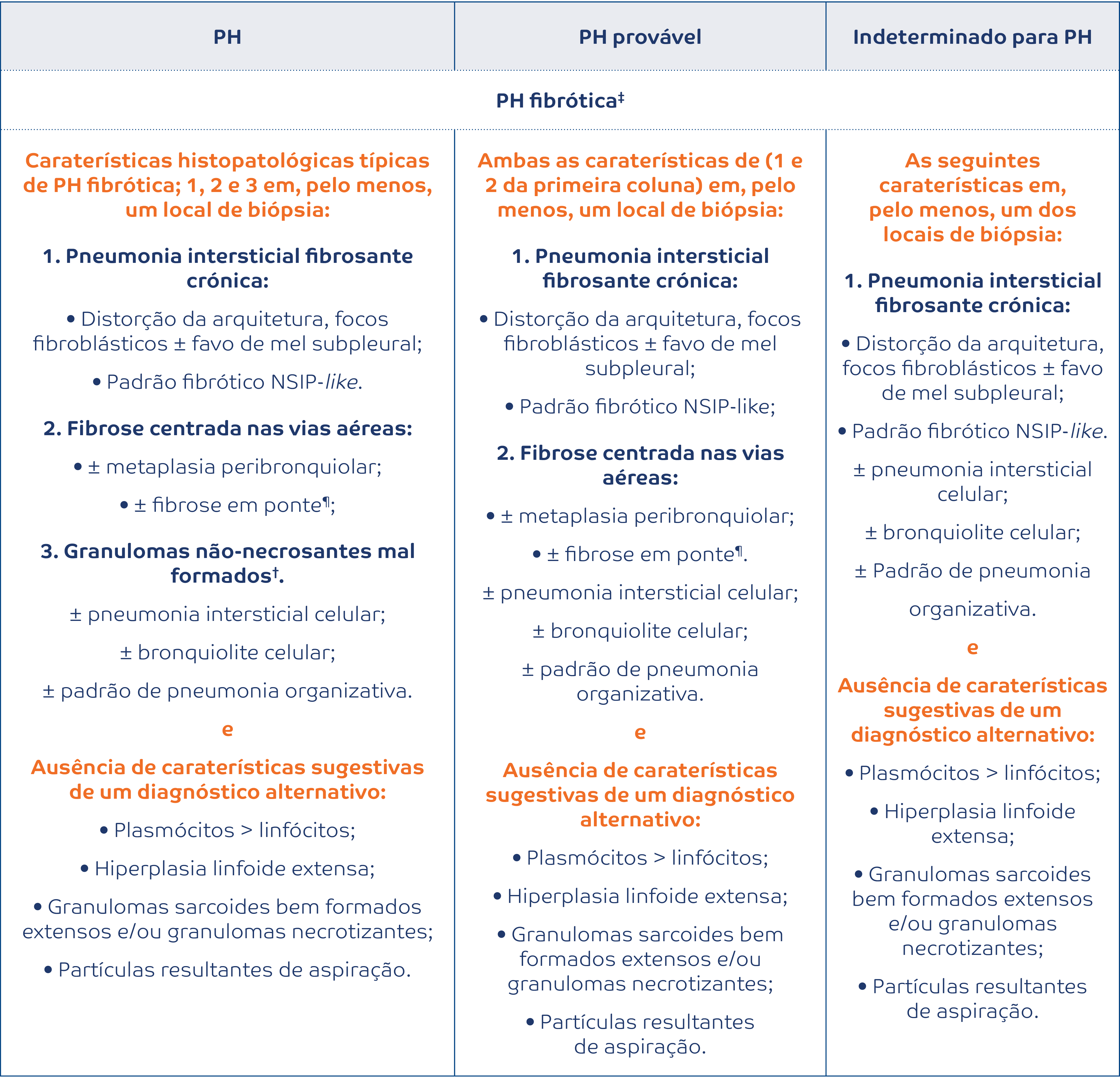
*Os achados histológicos da hot-tub lung são distintos das formas clássicas de PH fibrótica e não-fibrótica. † Os granulomas em PH são mais pequenos, mais laxos e não possuem a fibrose hialina perigranulomatosa, caraterística da sarcoidose. ‡ A PH fibrótica pode evidenciar as caraterísticas clássicas de PH não-fibrótica (PH celular) em áreas menos fibróticas ou não fibróticas; se presente, esta combinação de achados aponta para o diagnóstico de PH. ¶ fibrose em ponte estende-se da região subpleural à centriacinar ou liga focos fibróticos centriacinares vizinhos.
PH: pneumonite de hipersensibilidade; PII: Pneumonia intersticial idiopática; NSIP: pneumonia intersticial não-específica; UIP: pneumonia intersticial usual.
A apresentação da PH é muito variável e o seu diagnóstico diferencial relativamente a outras doenças do interstício pulmonar constituiu, em muitas situações, um desafio. Na PH nenhum teste é, por si só, diagnóstico; existem limitações dos meios complementares de diagnóstico disponíveis, bem como da sua precisão. Em muitas situações temos que lidar com a incerteza no seu diagnóstico e iniciar terapêuticas sem o diagnóstico definitivo.1,24
O diagnóstico poderá ser particularmente complexo quando
a exposição
ao Ag não é clara. Em estudos prévios foram
identificadas caraterísticas
que aumentam a probabilidade de diagnóstico de PH. Os
aspetos mais
consistentemente identificados foram a identificação da
exposição a
potenciais antigénios e alterações imagiológicas e
histológicas típicas.1,16,25
A linfocitose no lavado bronco alveolar (LBA) também é
um achado relevante
e as precipitinas séricas poderão também ser
úteis.25 Nenhum achado
isoladamente é diagnóstico. O diagnóstico de PH
necessita da integração
de diferentes domínios e deverá ser realizado em
contexto de reunião
multidisciplinar (RMD). Os critérios de diagnóstico
publicados recentemente
realçam a importância de três domínios:
a) Identificação de uma exposição
(história clínica, com ou sem questionário,
presença de IgG séricas especificas para potenciais
Ag);
b) Padrão imagiológico, e
c) Linfocitose no LBA/resultados
histológicos.1
Nesse documento definiu-se ainda os critérios radiológicos e histológicos típicos desta entidade, e, da combinação destes diferentes domínios, é determinado o grau de confiança para o diagnóstico desta patologia, categorizado como definitivo, elevado, moderado ou baixo. Os critérios de diagnóstico para abordagem desta patologia foram publicados e aplicam-se aos doentes com PH com padrão não-fibrótico e fibrótico. O principal objetivo é obter um diagnóstico com elevado grau de confiança e com a abordagem menos invasiva. A PH pode ser diagnosticada com elevado grau de confiança se a exposição foi identificada, se o TC for típico e se apresentar linfocitose no LBA. Todas as outras combinações deverão ser discutidas em RMD, por radiologistas, anatomopatologistas e pneumologistas com experiência em DPI e avaliada a necessidade de caraterização histológica. Existem situações em que por recusa, ausência de condições para exames invasivos, ou mesmo por histologia não-diagnóstica, não é possível um diagnóstico definitivo, sendo necessário aceitar um diagnóstico com baixo grau de confiança. Nestes casos, o diagnóstico deverá ser revisto e reavaliado em visitas subsequentes.
A monitorização e orientação terapêutica da PH é variável, por diferentes razões: o diagnóstico de PH é estabelecido, muitas vezes, com baixa confiança, por vezes protelando o reconhecimento da doença e a decisão de tratar; a identificação do antigénio causal muitas vezes não é conseguida; o comportamento clínico da doença é, muitas vezes, imprevisível, com heterogeneidade fenotípica e prognóstico variável; escassez de dados prospetivos e robustos no tratamento da PH.
Assim, a decisão de tratar um doente com PH vai depender da extensão e gravidade da doença, tendo em conta os dados clínicos, funcionais e imagiológicos, basais e longitudinais; presença ou não de fibrose na TCAR do tórax; fatores relacionados com o doente como idade, comorbilidades e preferências; objetivos do tratamento (estabilização vs. paliação); experiência pessoal do médico.24
• Evicção do antigénio: Tendo em conta que a exposição a um determinado antigénio é a causa desta doença, é lógico que a sua evicção é de importância primordial, independentemente do fenótipo apresentado. De facto, o reconhecimento do antigénio causador e a sua evicção é a atitude com mais impacto na redução do risco de desenvolvimento de PH, progressão de doença e exacerbação;26-29
• PH não-fibrótica: Tendo em consideração as propriedades anti-inflamatórias dos corticoides, faz sentido a sua utilização na PH não-fibrótica. Apesar da evidência limitada, os corticoides são frequentemente utilizados, tendo por base estudos no pulmão do fazendeiro nos quais se verificou melhoria da função pulmonar a curto prazo, não se tendo, no entanto, documentado benefício em termos de prognóstico a longo prazo.29-31 Um esquema terapêutico frequentemente utilizado consiste em 0,5 mg/kg/dia de prednisolona (ou equivalente) por uma a duas semanas, com desmame gradual até uma dose de manutenção de 10 mg/ dia.13 A azatioprina (AZA) ou o micofenolato de mofetil (MMF) têm sido utilizados no sentido de reduzir os efeitos laterais associados à corticoterapia, tratamento de recidivas ou quando a evicção antigénica é impossível;
• PH fibrótica: Corticoterapia e
Imunossupressores: Apesar da escassa
evidência, os corticoides isolados ou em combinação com
AZA ou MMF são
o tratamento mais frequente da PH fibrótica. Morisset et
al. documentaram,
num estudo retrospetivo, melhoria significativa da
capacidade de transferência alvéolo-capilar de monóxido
de carbono (DLCO) (mas não da capacidade
vital forçada [FVC]) ao fim de um mês de tratamento com
AZA ou
MMF.32 A presença de linfocitose no LBA
parece associar-se a uma resposta
favorável à imunossupressão (especialmente a AZA), mas
apenas nos
primeiros 6-12 meses de tratamento, observando-se
posterior declínio da
FVC.29,33 Já a presença de favo de mel no
TCAR do tórax, LBA sem linfocitose
e telómeros curtos parecem associar-se a má resposta à
imunossupressão.29,34
Ainda dentro dos imunossupressores, existe alguma
evidência de que
o rituximab pode estabilizar ou melhorar a função
pulmonar em alguns
pacientes com PH fibrótica, em particular na ausência de
padrão UIP ou
NSIP.35 Também a leflunomida poderá evitar o
declínio da função pulmonar,
nos doentes com PH fibrótica com < 20% da extensão de
fibrose, no entanto, os efeitos laterais
gastrointestinais podem levar à sua descontinuação
em até 40% dos doentes.36
Fármacos antifibróticos: Os
antifibróticos têm-se tornado uma opção
terapêutica atrativa no tratamento da PH fibrótica
quando se constata
progressão da doença, mesmo com evicção antigénica e
terapêutica
imunossupressora. A eficácia e a segurança da
pirfenidona foram avaliadas
no estudo RELIEF, no qual 45% dos doentes tinham PH
fibrótica. Este estudo
foi encerrado precocemente por baixo recrutamento,
limitando a sua análise,
no entanto, a adição de pirfenidona à medicação em curso
traduziu-se numa
redução do declínio da FVC, resultado similar ao do
estudo de vida real de
uma coorte de pacientes com PH fibrótica de Shibata et
al.37,38
O ensaio INBUILD, que incluíu doentes com doença
pulmonar intersticial com
fenótipo fibrosante progressivo, demonstrou benefício do
nintedanib na redução do declínio anual da função
pulmonar avaliado pela FVC, quando comparado com
placebo. Neste estudo, 26% da população era constituída
por doentes
com PH. Curiosamente, não se verificou, neste subgrupo,
diferenças estatisticamente significativas entre o grupo
de nintedanib vs. placebo, no entanto, o
ensaio não foi desenhado para a análise de evidência em
subgrupos específicos.39,40 Por fim, os
doentes com PH fibrótica, grave e progressiva, devem ser
considerados para transplante pulmonar.41
Medidas não-farmacológicas: Não menos
importante, devem ser consideradas no tratamento da PH
as diferentes medidas não-farmacológicas
como a oxigenoterapia; reabilitação respiratória;
cessação tabágica; vacinação; profilaxia de infeção por
pneumocystis; prevenção de efeitos laterais
induzidos pela corticoterapia; referenciação atempada
para transplante
pulmonar; e cuidados paliativos.24,42
A monitorização do doente com PH deve ter em conta a
clínica, os achados
funcionais e imagiológicos. Não estando claramente
definidos os timings
para realização dos diferentes exames, os autores
consideram sensato a
realização de provas funcionais respiratórias cada três
a seis meses e TCAR
do tórax anual, periodicidade meramente indicativa, já
que se trata de uma
doença com forma de apresentação e evolução muito
heterogénea.
As exacerbações agudas (EA) podem ocorrer em doentes com PH, especialmente aquelas com padrões radiológicos e/ou histológicos UIP ou NSIP.11,43,44 Kang et al. descrevem uma incidência de 17,8% em 101 pacientes com PH comprovada histologicamente, e uma mortalidade intra-hospitalar associada de 44,4%. O padrão radiológico de UIP e uma DLCO mais baixa associaram-se a maior risco de EA.45 Um outro estudo retrospectivo com 100 casos de pulmão de criador de pombos demonstrou uma frequência de EA de 11,5% aos dois anos e um maior risco de EA associado ao sexo masculino, pior função pulmonar e LBA neutrofílico, bem como o padrão radiológico de UIP.46
Assim, existe evidência de que os doentes com PH fibrótica, particularmente com padrão de UIP, estão em maior risco de EA, pelo que o clínico deve estar consciente desta possibilidade perante um quadro de deterioração clínicoradiológica subaguda, não explicado por causas extraparenquimatosas.
À semelhanca da FPI, não existe evidência robusta no tratamento da EA por PH, e o seu tratamento é extrapolado de dados de doentes com FPI. Este consiste em medidas de suporte e, caso haja uma baixa probabilidade de infeção, corticoterapia em doses altas (recomendação fraca, com baixa qualidade de evidência). A utilização de imunossupressores com ciclosporina, ciclofosfamida, rituximab ou outros tratamentos como a trombomodulina recombinante humana, macrólidos ou cotrimoxazol permanecem sem eficácia comprovada.47,48
O prognóstico da PH é bastante heterogéneo, havendo doentes que evoluem para fibrose progressiva, falência respiratória e morte, com subgrupos a presentarem sobrevidas semelhantes à FPI.49,50 Numa publicação recente foi identificada uma série fatores associados ou preditores de sobrevida: caraterísticas demográficas; hábitos tabágicos; identificação e caraterísticas da exposição ao Ag; comorbilidades e marcadores fisiológicos, radiológicos e laboratoriais (Figura 1).50
Alguns aspetos estão consistentemente associados a uma maior mortalidade, como idade mais avançada, repercussão funcional mais severa à data do diagnóstico. Sexo masculino e Ag desconhecido parecem estarem também associados a uma maior mortalidade, mas os estudos não são consensuais.26,50 A presença de comorbilidades como hipertensão pulmonar, doenças autoimunes, fibroelastose pleuropulmonar associam-se a um pior prognóstico.50 A presença de fibrose (radiológica/histológica) está associada a maior mortalidade, particularmente na presença de favo de mel, maior extensão da doença e um maior volume vascular pulmonar. Salisbury avaliou um grupo de doentes com PH, de acordo com o fenótipo radiológico: o grupo de doentes sem evidência de fibrose apresentou uma melhoria progressiva da FVC, com sobrevida mediana livre de eventos > 14,73 anos; o grupo com fibrose sem favo apresentou uma sobrevida mediana de 7,95 anos; e o grupo com favo de mel apresentou uma sobrevida semelhante ao de uma corte emparelhada de doentes com FPI: 2,76 anos vs. 2,81 anos. A presença de polimorfismos do MUC5B e o encurtamento dos telómeros também são preditores de progressão.50
Figura 1: Sumário de fatores associados a aumento da mortalidade (adaptado de Creamer et al. Eur Respir Rev. 2020). Ag: antigénio; FVC: capacidade vital forçada; DLCO capacidade de difusão do CO; PH: pneumonite de hipersensibilidade; VVP: volume vascular pulmonar; UIP: pneumonia intersticial usual; NSIP: pneumonia intersticial não-específica.
1. Raghu G, Wilson KC, Bargagli E, Bendstrup E, Chami HA, Chua AT, et al. Diagnosis of hypersensitivity pneumonitis in adults: An official ATS/ JRS/ALAT clinical practice guideline. American Journal of Respiratory and Critical Care Medicine. 2020;202(3):e36-e69.
2. Vasakova M, Morell F, Walsh S, Leslie K, Raghu G. Hypersensitivity pneumonitis: Perspectives in diagnosis and management. American Journal of Respiratory and Critical Care Medicine. 2017;196(6):680-89.
3. Sesé L, Khamis W, Jeny F, Uzunhan Y, Duchemann B, Valeyre D, et al. Adult interstitial lung diseases and their epidemiology. Presse Medicale. 2020;49(2):104023.
4. Perez ERF, Kong AM, Raimundo K, Koelsch TL, Kulkarni R, Cole AL. Epidemiology of hypersensitivity pneumonitis among an insured population in the United States: A claims-based cohort analysis. Ann Am Thorac Soc. 2018;15(4):460-9.
5. Cramer C, Schlünssen V, Bendstrup E, Stokholm ZA, Vestergaard JM, Frydenberg M, et al. Risk of hypersensitivity pneumonitis and interstitial lung diseases among pigeon breeders. Eur Respir J. 2016;48(3):818-25.
6. Singh S, Collins BF, Sharma BB, Joshi JM, Talwar D, Katiyar S, et al. Interstitial lung disease in India results of a prospective registry. Am J Respir Crit Care Med. 2017;195(6):801-13.
7. Thomeer MJ, Costabel U, Rizzato G, Poletti V, Demedts M. Comparison of registries of interstitial lung diseases in three European countries. Eur Respir Journal, Suppl. 2001;32:114s-118s.
8. Costabel U, Miyazaki Y, Pardo A, Koschel D, Bonella F, Spagnolo P, et al. Hypersensitivity pneumonitis. Nat Rev Dis Prim. 2020;6(1):65.
9. Ley B, Newton CA, Arnould I, Elicker BM, Henry TS, Vittinghoff E, et al. The MUC5B promoter polymorphism and telomere length in patients with chronic hypersensitivity pneumonitis: an observational cohort-control study. Lancet Respir Med. 2017;5(8):639-47.
10. Selman M, Pardo A, King TE. Hypersensitivity pneumonitis: Insights in diagnosis and pathobiology. American Journal of Respiratory and Critical Care Medicine. 2012;186(4):314-24.
11. Churg A, Sin DD, Everett D, Brown K, Cool C. Pathologic patterns and survival in chronic hypersensitivity pneumonitis. Am J Surg Pathol. 2009;33(12):1765-70.
12. Adegunsoye A, Oldham JM, Demchuk C, Montner S, Vij R, Strek ME. Predictors of survival in coexistent hypersensitivity pneumonitis with autoimmune features. Respir Med. 2016;114:53-60.
13. Spagnolo P, Rossi G, Cavazza A, Paladini I, Paladini I, Bonella F, et al. Hypersensitivity pneumonitis: A comprehensive review. Journal of Investigational Allergology and Clinical Immunology. 2015;25(4):237-50.
14. Barnes H, Lu J, Glaspole I, Collard HR, Johannson KA. Exposures and associations with clinical phenotypes in hypersensitivity pneumonitis: A scoping review. Respiratory Medicine. 2021184:106444.
15. Richerson HB, Bernstein IL, Fink JN, Hunninghake GW, Novey HS, Reed CE, et al. Guidelines for the clinical evaluation of hypersensitivity pneumonitis. Report of the Subcommittee on Hypersensitivity Pneumonitis. J Allergy Clin Immunol. 1989;84(5 Pt 2):839-44.
16. Morisset J, Johannson KA, Jones KD, Wolters PJ, Collard HR, Walsh SLF, et al. Identification of diagnostic criteria for chronic hypersensitivity pneumonitis: An international modified Delphi survey. Am J Respir Crit Care Med. 2018;197(8):1036-44.
17. Tateishi T, Ohtani Y, Takemura T, Akashi T, Miyazaki Y, Inase N, et al. Serial high-resolution computed tomography findings of acute and chronic hypersensitivity pneumonitis induced by avian antigen. J Comput Assist Tomogr. 2011;35(2):272-9.
18. Adler BD, Padley SPG, Muller NL, Remy-Jardin M, Remy J. Chronic hypersensitivity pneumonitis: High-resolution CT and radiographic features in 16 patients. Radiology. 1992;185(1):91-5.
19. Chung JH, Montner SM, Adegunsoye A, Oldham JM, Husain AN, Vij R, et al. CT findings associated with survival in chronic hypersensitivity pneumonitis. Eur Radiol. 2017;27(12):5127-35.
20. Barnett J, Molyneaux PL, Rawal B, Abdullah R, Hare SS, Vancheeswaran R, et al. Variable utility of mosaic attenuation to distinguish fibrotic hypersensitivity pneumonitis from idiopathic pulmonary fibrosis. Eur Respir J. 2019;54(1):1900531.
21. Remy-Jardin M, Remy J, Wallaert B, Muller NL. Subacute and chronic bird breeder hypersensitivity pneumonitis: Sequential evaluation with CT and correlation with lung function tests and bronchoalveolar lavage. Radiology. 1993;189(1):111-8.
22. Lynch DA, Newell JD, Logan PM, King TE, Müller NL. Can CT distinguish hypersensitivity pneumonitis from idiopathic pulmonary fibrosis? Am J Roentgenol. 1995; 165(4):807-11.
23. Salisbury ML, Gross BH, Chughtai A, Sayyouh M, Kazerooni EA, Bartholmai BJ, et al. Development and validation of a radiological diagnosis model for hypersensitivity pneumonitis. Eur Respir J. 2018;52:1800443.
24. Pérez ERF, Koelsch T, Leone PM, Groshong SD, Lynch DA, Brown KK. Clinical Decision-Making in Hypersensitivity Pneumonitis: Diagnosis and Management. Semin Respir Crit Care Med. 2020.
25. Lacasse Y, Selman M, Costabel U, Dalphin JC, Ando M, Morell F, et al. Clinical Diagnosis of Hypersensitivity Pneumonitis. Am J Respir Crit Care Med. 2003;168(8): 952-8.
26. Pérez ERF, Swigris JJ, Forssén A V, Tourin O, Solomon JJ, Huie TJ, et al. Identifying an inciting antigen is associated with improved survival in patients with chronic hypersensitivity pneumonitis. Chest. 2013;144(5):1644-51.
27. Zacharisen MC, Schlueter DP, Kurup VP, Fink JN. The long-term outcome in acute, subacute, and chronic forms of pigeon breeder’s disease hypersensitivity pneumonitis. Ann Allergy, Asthma Immunol. 2002;88(2): 175-82.
28. Gimenez A, Storrer K, Kuranishi L, Soares MR, Ferreira RG, Pereira CAC. Change in FVC and survival in chronic fibrotic hypersensitivity pneumonitis. Thorax. 2018;73(4): 391-2.
29. De Sadeleer LJ, Hermans F, De Dycker E, Yserbyt J, Verschakelen JA, Verbeken EK, et al. Effects of corticosteroid treatment and antigen avoidance in a large hypersensitivity pneumonitis cohort: A single-centre cohort study. J Clin Med. 2019;
30. Cano-Jiménez E, Rubal D, Pérez de Llano LA, Mengual N, Castro-Añón O, Méndez L, et al. Farmer’s lung disease: Analysis of 75 cases. Med Clin (Barc). 2017;149(10): 429-35.
31. Kokkarinen JI, Tukiainen HO, Terho EO. Recovery of pulmonary function in farmer’s lung: A five-year follow-up study. Am Rev Respir Dis. 1993;147(4):793-6.
32. Morisset J, Johannson KA, Vittinghoff E, Aravena C, Elicker BM, Jones KD, et al. Use of Mycophenolate Mofetil or Azathioprine for the Management of Chronic Hypersensitivity Pneumonitis. Chest. 2017;151(3):619-25.
33. Raimundo S, Pimenta AC, Cruz-Martins N, Rodrigues MC, Melo N, Mota PC, et al. Insights on chronic hypersensitivity pneumonitis’ treatment: Factors associated with a favourable response to azathioprine. Life Sci. 2021;272:119274.
34. Adegunsoye A, Morisset J, Newton CA, Oldham JM, Vittinghoff E, Linderholm AL, et al. Leukocyte telomere length and mycophenolate therapy in chronic hypersensitivity pneumonitis. European Respiratory Journal. 2021;57:2002872.
35. Ferreira M, Borie R, Crestani B, Rigaud P, Wemeau L, Israel-Biet D, et al. Efficacy and safety of rituximab in patients with chronic hypersensitivity pneumonitis (cHP): A retrospective, multicentric, observational study. Respir Med. 2020;172:106146.
36. Noh S, Yadav R, Li M, Wang X, Sahoo D, Culver DA, et al. Use of leflunomide in patients with chronic hypersensitivity pneumonitis. BMC Pulm Med. 2020;20:199.
37. Behr J, Prasse A, Kreuter M, Johow J, Rabe KF, Bonella F, et al. Pirfenidone in patients with progressive fibrotic interstitial lung diseases other than idiopathic pulmonary fibrosis (RELIEF): a double-blind, randomised, placebo-controlled, phase 2b trial. Lancet Respir Med. 2021; 9(5):476-86.
38. Shibata S, Furusawa H, Inase N. Pirfenidone in chronic hypersensitivity pneumonitis: A real-life experience. Sarcoidosis Vasc Diffus Lung Dis. 2018;35(2):139-42.
39. Flaherty KR, Wells AU, Cottin V, Devaraj A, Walsh SLF, Inoue Y, et al. Nintedanib in Progressive Fibrosing Interstitial Lung Diseases. N Engl J Med. 2019;381(18): 1718-27.
40. Wells AU, Flaherty KR, Brown KK, Inoue Y, Devaraj A, Richeldi L, et al. Nintedanib in patients with progressive fibrosing interstitial lung diseases—subgroup analyses by interstitial lung disease diagnosis in the INBUILD trial: a randomised, double-blind, placebo-controlled, parallel-group trial. Lancet Respir Med. 2020;8(5):453-60.
41. Weill D, Benden C, Corris PA, Dark JH, Davis RD, Keshavjee S, et al. A consensus document for the selection of lung transplant candidates: 2014 - An update from the Pulmonary Transplantation Council of the International Society for Heart and Lung Transplantation. Journal of Heart and Lung Transplantation. 2015;34(1):1-15.
42. Kreuter M, Bendstrup E, Russell AM, Bajwah S, Lindell K, Adir Y, et al. Palliative care in interstitial lung disease: living well. The Lancet Respiratory Medicine. 2017; 5(12):968-80.
43. Churg A, Müller NL, Silva CIS, Wright JL. Acute exacerbation (acute lung injury of unknown cause) in UIP and other forms of fibrotic interstitial pneumonias. Am J Surg Pathol. 2007;31(2):277-84.
44. Olson AL, Huie TJ, Groshong SD, Cosgrove GP, Janssen WJ, Schwarz MI, et al. Acute exacerbations of fibrotic hypersensitivity pneumonitis: A case series. Chest. 2008;134(4):844-50.
45. Kang J, Kim YJ, Choe J, Chae EJ, Song JW. Acute exacerbation of fibrotic hypersensitivity pneumonitis: incidence and outcomes. Respir Res. 2021;22(152).
46. Miyazaki Y, Tateishi T, Akashi T, Ohtani Y, Inase N, Yoshizawa Y. Clinical predictors and histologic appearance of acute exacerbations in chronic hypersensitivity pneumonitis. Chest. 2008;134(6):1265-70.v
47. Meyer KC. Acute exacerbations of interstitial lung disease: What is the best treatment? Sarcoidosis Vasculitis and Diffuse Lung Diseases. 2021;38(1):e 2021001.
48. Raghu G, Rochwerg B, Zhang Y, Garcia CAC, Azuma A, Behr J, et al. An official ATS/ERS/JRS/ALAT clinical practice guideline: Treatment of idiopathic pulmonary fibrosis: An update of the 2011 clinical practice guideline. Am J Respir Crit Care Med. 2015;192(2):e3-19.
49. Salisbury ML, Gu T, Murray S, Gross BH, Chughtai A, Sayyouh M, et al. Hypersensitivity Pneumonitis: Radiologic Phenotypes Are Associated With Distinct Survival Time and Pulmonary Function Trajectory. Chest. 2019; 155(4):699-711.
50. Creamer AW, Barratt SL. Prognostic factors in chronic hypersensitivity pneumonitis. Eur Respir Rev. 2020; 29(156):190167.

Não Específica idiopática
-
Pneumologistas
Serviço de Pneumologia do Hospital da Luz Lisboa/ Hospital Beatriz Ângelo

A pneumonia intersticial não específica idiopática (iNSIP) é uma pneumonia intersticial idiopática (PII), pertencendo ao grupo das doenças pulmonares difusas. A primeira classificação das PII foi elaborada por Liebow e Carrington, em 1969.1 No entanto, o reconhecimento da NSIP como um padrão histológico distinto surgiu 25 anos depois, por Katzenstein e Fiorelli.2 Em 2002, com o Consenso da Classificação das PII pela American Thoracic Society (ATS) e European Respiratory Society (ERS)3, a iNSIP ainda foi encarada como uma área de incerteza, difícil de diferenciar de outras PII. Muitas das suas características são inespecíficas e podem ser identificadas noutros contextos clínicos (Tabela 1), particularidades estas que fazem jus ao seu nome.
Tabela 1. Condições clínicas associadas ao padrão histológico de NSIP (adaptado de 3,5)
• Sem causa identificada (iNSIP)
• Doença vascular do colagénio
• Pneumonite de hipersensibilidade
• Pneumonite induzida por fármacos
• Infecções
• Imunodeficiência (infeção pelo VIH - Vírus da Imunodeficiência Humana)
• Fibrose pulmonar familiar
Contudo, uma revisão por Travis et al.4 , publicada em 2008, expôs esta entidade como tendo características clínicas, radiológicas e patológicas distintas das restantes PII. De facto, a iNSIP veio a ser aceite como uma entidade clínicopatológica distinta na atualização da classificação das PII, ultimada em 2013 pelas ATS e ERS.5 Nesta classificação, a iNSIP foi incluída no grupo das PII major e fibrosantes crónicas (Tabela 2).
Tabela 2. Classificação das pneumonias intersticiais idiopáticas (PII) (adaptado de 5)
I. PII major
I.1. Fibrosantes crónicasI.1.1. FPI - Fibrose Pulmonar IdiopáticaI.1.2. NSIP - Pneumonia Intersticial Não EspecíficaI.2. Relacionadas com o tabagismo
I.2.1. RB-ILD - Bronquiolite Respiratória Associada a Doença Pulmonar IntersticialI.2.2. DIP - Pneumonia Intersticial DescamativaI.3. Agudas / Sub-agudas
I.3.1. COP - Pneumonia Organizativa CriptogénicaI.3.2. AIP - Pneumonia Intersticial AgudaII. PII raras
III. PII inclassificáveis
Posteriormente, alguns autores6 ainda especulam a iNSIP como um conjunto de diversas entidades com um padrão histológico comum, e não como mais uma entidade distinta, com base, por exemplo, no reconhecimento da sua associação com a autoimunidade.7,8
Os sintomas da iNSIP, tais como tosse e dispneia, são
inespecíficos e podem
estar presentes em todas as PII, nomeadamente a fibrose
pulmonar idiopática
(FPI), mas podem incluir sintomas constitucionais (e.g.
febre, fadiga, etc.).
A apresentação habitual é a presença destes sintomas com
6-7 meses de
evolução, em mulheres não fumadoras e de meia-idade,
contrastando com
a FPI na distribuição pelos géneros, hábitos tabágicos e
prognóstico que, na
iNSIP, é mais favorável.
O exame objetivo e a avaliação
funcional respiratória
são, igualmente, inespecíficos.
As alterações radiológicas mais comuns na tomografia computorizada de alta resolução (TCAR) torácica são a presença de opacidades em “vidro despolido” e reticulares irregulares, com bronquiectasias de tração, de distribuição bilateral e simétrica, com perda de volume lobar. Tipicamente, estas alterações poupam a região subpleural, permitindo a distinção entre os padrões de NSIP e pneumonia intersticial usual (UIP), sobretudo se não coexistirem alterações em “favo de mel” ou se estas forem escassas.4,5
As características histológicas da NSIP reconhecem-se, tipicamente, num espectro desde o padrão celular, que se traduz em inflamação intersticial de intensidade variável, ao padrão fibrótico, com fibrose intersticial de aparência temporal e espacialmente uniforme. Algumas características patológicas conferem dificuldades diagnósticas, constituindo desafios em determinadas situações, tais como a presença, num terço dos casos, do padrão de NSIP e do de UIP em biópsias distintas do mesmo doente, com o diagnóstico final de FPI9; alguns casos de pneumonia organizativa (OP) podem apresentar inflamação intersticial mais pronunciada, assemelhando-se ao padrão NSIP celular; a progressão da pneumonia intersticial aguda (AIP) pode evoluir para fibrose, com padrão semelhante ao da NSIP fibrótica.3,4
A identificação da iNSIP é difícil, evidenciando o papel fundamental da reunião multidisciplinar para estabelecer o diagnóstico.
Os dados epidemiológicos referentes à incidência e prevalência das doenças pulmonares difusas são escassos e os existentes apresentam limitações metodológicas. As disparidades entre os dados das diversas publicações podem refletir diferenças metodológicas, complexidade do diagnóstico multidisciplinar, atualização de critérios diagnósticos ou verdadeiras diferenças genéticas e demográficas.
As PII major fibrosantes crónicas (FPI e iNSIP) constituem mais de dois terços das PII. Em 2001, Flaherty et al.10 extrapolaram, de dados referentes à FPI, uma prevalência para a NSIP de 0,4 - 8,0/100.000. Posteriormente, o registo europeu da FPI (eurIPFreg)11, identificou iNSIP em 2,9% de 1086 doentes com patologia intersticial pulmonar. Num estudo observacional de Duchemann et al.12 que decorreu numa região multiétnica de Paris, foi encontrada uma prevalência de 1,7/100.000 habitantes e uma incidência de 0,8/100.000/ano para a iNSIP, colocando-a em segundo lugar no grupo das PII, a seguir à FPI. Hyldgaard et al.9 estimaram uma incidência de 3,0/1.000.000 habitantes/ano. Nesta coorte dinamarquesa, a FPI foi o diagnóstico mais comum (28%), seguido da Pneumonite Intersticial associada a doença do tecido conjuntivo (DPI-DTC) (14%), da pneumonite de hipersensibilidade (PH) (7%) e da NSIP (7%).
A compreensão da patogénese da iNSIP tem vindo a aumentar nas últimas décadas, com várias hipóteses ainda em debate.
Alguns factores foram identificados como potenciais contribuintes para o desenvolvimento da doença, nomeadamente a lesão epitelial, a desregulação dos mecanismos de reparação, o envolvimento do sistema imunitário e até uma função anormal dos fibroblastos e miofibroblastos.14
A NSIP celular, a NSIP fibrótica e a UIP poderiam representar um espectro de alterações, desde a inflamação ligeira à fibrose terminal observada na UIP, hipótese esta levantada pela descrição de padrões de NSIP e de UIP em biópsias do mesmo doente9; descrições mais recentes, evidenciaram a progressão de NSIP para UIP ao longo do tempo, num pequeno grupo de doentes.15,16 Outra hipótese seria a da NSIP como um processo autoimune e inflamatório, podendo aquela ser explicada pela sua presença frequente em doentes com DPI-DTC (doença pulmonar intersticial associada a doença do tecido conjuntivo)8 e pela infiltração por linfócitos documentada na histologia.2
A existência de stress oxidativo anormal pode, igualmente, contribuir para a patogénese da NSIP.14
A evidência sobre o melhor tratamento é parca e provém maioritariamente da experiência clínica.
Devem considerar-se medidas gerais, tais como a cessação tabágica, a vacinação, a profilaxia de infeções e o controlo de comorbilidades. Apesar de se tratar de uma entidade idiopática, é frequente identificar-se possíveis triggers de progressão de doença (e.g. refluxo gastro-esofágico, exposição ambiental ou a fármacos) que devem ser minimizados.17
A escolha das opções terapêuticas pode ser feita com base no comportamento clínico da doença, classificado de acordo com a proposta da ATS/ERS, de 2013.5
Uma estratégia conservadora pode ser adoptada na doença limitada ou estável, requerendo uma monitorização meticulosa da sua evolução, com vista a intervenção precoce em caso de progressão para obter regressão ou estabilidade17;na doença ligeira, pode recorrer-se a corticoterapia sistémica em monoterapia; se se tratar de doença mais grave ou progressiva, a terapêutica combina corticosteróides com imunossupressor (azatioprina, micofenolato de mofetil, metotrexato, inibidores da calcineurina, ciclofosfamida, rituximab). A dose ótima e a duração do tratamento são desconhecidas, devendo ser individualizadas, considerando a gravidade da doença e a sua progressão.
A pirfenidona e o nintedanib são dois antifibróticos recomendados no tratamento da FPI, para os quais tem havido interesse crescente do seu uso no tratamento da NSIP, proveniente de estudos com populações com DPI-DTC. A pirfenidona mostrou, numa população de doentes com DPI-DTC com doença subaguda18, uma tendência para reduzir a mortalidade. A sua eficácia e segurança pareceram favoráveis, de acordo com um estudo19 que incluiu doentes com pneumonia intersticial inclassificável progressiva (neste grupo, podem estar incluídos doentes com NSIP). O seu perfil de tolerância foi considerado aceitável em doentes com esclerose sistémica, não tendo sido afectada pelo tratamento concomitante com micofenolato de mofetil20, imunossupressor que pode ser utilizado nos doentes com iNSIP.
O nintedanib revelou-se como um antifibrótico eficaz e com um perfil de segurança favorável em doentes com esclerose sistémica, atrasando o declínio da sua função pulmonar, independentemente do uso do micofenolato de mofetil.21 doença intersticial fibrótica progressiva — que inclui diversas entidades, nomeadamente a iNSIP —, verificou-se uma redução significativa da taxa de declínio da capacidade vital forçada (FVC) nos doentes sob nintedanib versus placebo.22 Atualmente, a European Medicines Agency (EMA) e a Food and Drug Administration (FDA) já recomendam a utilização deste fármaco noutras doenças intersticiais fibróticas crónicas de fenótipo progressivo (que incluem a iNSIP), para além da fibrose pulmonar idiopática.
O tratamento não farmacológico tem um papel fundamental na abordagem da iNSIP, uma vez que se trata de uma doença complexa, responsável por sintomas e perda da função pulmonar, ansiedade, depressão, redução da tolerância ao exercício e da qualidade de vida dos doentes e seus familiares.23 Uma abordagem holística pode incluir, para além do tratamento farmacológico, a reabilitação respiratória, a oxigenoterapia e os cuidados paliativos.24
A integração dos doentes em grupos de suporte pode ser útil, ajudando-os a relacionar-se com outros doentes que apresentam necessidades semelhantes. Um exemplo destes grupos em Portugal é a Respira, uma associação vocacionada para doentes com diversas doenças respiratórias crónicas.
A educação permite, aos doentes e familiares, aumentar o seu conhecimento sobre a doença e sua história natural. Os programas educacionais podem integrar programas de reabilitação respiratória que demonstraram ser igualmente viáveis e benéficos nestes doentes, à semelhança da DPOC, onde a evidência científica é mais robusta.25 De facto, a evidência atual posiciona a reabilitação respiratória como uma intervenção segura, capaz de melhorar a capacidade de exercício, a dispneia e a qualidade de vida destes doentes.26
O impacto na função respiratória alia-se, muitas vezes, a insuficiência respiratória e a hipoxémia induzida pelo exercício é, frequentemente, profunda. Muito embora não exista evidência de que a oxigenoterapia de longa duração aumente a sobrevida de doentes com fibrose pulmonar e insuficiência respiratória,27 a prescrição de oxigenoterapia traz benefícios na melhoria da capacidade de exercício que são mais consistentes do que no alívio da dispneia.28
A iNSIP pode ser uma doença incapacitante, sintomática e com perda da qualidade de vida. Os cuidados paliativos são um tratamento abrangente desta faceta da doença e, uma vez que a evolução da doença é imprevisível, devem ser iniciados assim que esta seja diagnosticada.24
As exacerbações das doenças pulmonares difusas constituem eventos graves na sua história natural e pioram o seu prognóstico. Ocorrem em qualquer fase da história natural da doença, podendo inclusivamente ser a sua forma de apresentação.
Não existe uma definição clara de exacerbação de uma doença intersticial não-FPI, dificultando a avaliação da sua incidência que parece ser menor do que na FPI. Na NSIP, regista-se uma incidência anual de 4,2%.29 Uma vez que estas exacerbações se assemelham às da FPI, pode ser razoável alargar a definição de exacerbação de FPI30 à das restantes doenças pulmonares difusas, tais como a iNSIP, carecendo, no entanto, de uma definição específica nestes casos.31 A sua apresentação clínica inclui o agravamento dos sintomas em menos de um mês e deterioração das trocas gasosas, acompanhados pelo aparecimento de novo de infiltrados alveolares bilaterais em “vidro despolido”, com ou sem consolidação, na TCAR, e exclusão de tromboembolismo pulmonar, enfarte agudo do miocárdio, insuficiência cardíaca ou de outro diagnóstico alternativo.
O tratamento das exacerbações apresenta fortes lacunas e, na prática clínica, baseia-se na corticoterapia sistémica em doses elevadas e antibioterapia. Outros fármacos têm sido usados nas exacerbações das doenças intersticiais não FPI, tais como a ciclosporina A, a ciclofosfamida e a trombomodulina intravenosa na NSIP31, mas, claramente, esta ainda é uma área que carece de evidência.
O tratamento de suporte pode incluir a paliação de sintomas e a oxigenoterapia. Existem opiniões diversas acerca do tecto para o tratamento de suporte, nomeadamente sobre a ventilação mecânica invasiva, tendendo para a sua não utilização, com base na elevada mortalidade associada ao seu uso na exacerbação da FPI. Contudo, um estudo retrospetivo que avaliou doentes com FPI ventilados invasivamente entre 2006 e 2012, mostrou uma descida na mortalidade de 58,4% em 2006 para 49,3% em 2012.32 Estes dados alertam para a necessidade de uma decisão individualizada e ponderada da ventilação mecânica invasiva, idealmente entre o médico, o doente e a sua família.31
A iNSIP tem uma taxa de sobrevivência de 80% aos 5 anos e de 73% aos 10 anos4, podendo utilizar-se o modelo GAP modificado ou ILD-GAP (Gender, Age, Physiology) para estimar a sobrevivência.33
No entanto, a história natural da iNSIP é imprevisível. O seu prognóstico é geralmente melhor do que o da FPI e inclui diversas possibilidades: alguns doentes melhoram, outros estabilizam e outros, ainda, agravam, com ou sem terapêutica.5
A extensão da fibrose tem impacto no prognóstico, parecendo haver diferenças na taxa de sobrevivência entre a NSIP celular e NSIP fibrótica, a favor da primeira.4,14
O padrão histológico basal é o melhor preditor de mortalidade das PII, mas os dados fisiológicos também fornecem informação relevante. Nos doentes com NSIP fibrótica e com DLCO (difusão do monóxido de carbono) inferior a 35% do previsto, o seu prognóstico e o da FPI tendem a ser semelhantes.34
Ainda assim, a mudança da função respiratória na evolução da doença parece ser mais importante do que a própria informação histológica.35
A avaliação da capacidade de exercício pode fornecer elementos prognósticos e facilitar decisões terapêuticas. Num estudo prospetivo que incluiu doentes com FPI e NSIP fibrótica, a dessaturação para valores inferiores a 88% na prova de marcha de 6 minutos associou-se a maior mortalidade.36
Desta forma, as características de pior prognóstico norteiam a referenciação do doente para transplante pulmonar: presença de NSIP fibrótica (independentemente da função respiratória); FVC inferior a 80% do previsto ou DLCO inferior a 40% do previsto; necessidade de oxigenoterapia, mesmo que apenas durante o esforço; resposta desfavorável ao tratamento imunossupressor, apresentando doença progressiva.34,37
Na avaliação da resposta ao tratamento e no follow-up dos doentes com iNSIP, apresenta-se uma proposta de monitorização, a adequar individualmente, e que sustenta a sua discussão dinâmica em reunião multidisciplinar (Tabela 3). 14
Tabela 3.Monitorização da iNSIP (adaptado de 14)
O acompanhamento destes doentes implica, para além da avaliação da função respiratória (FVC e DLCO) e imagiológica (TCAR), a monitorização de sintomas, da capacidade de exercício, de eventuais efeitos secundários da terapêutica e de comorbilidades.
1. Liebow AA, Carrington CB. The interstitial pneumonias. In: Simon M, Potchen EJ, Lemay E, eds. Frontiers in pulmonary radiology. New York: Grune and Stratton, 1969: 102-141.
2. Katzenstein AL, Fiorelli RE. Nonspecific interstitial pneumonia/fibrosis. Histologic features and clinical significance. Am J Surg Pathol 1994; 16: 136-147.
3. American Thoracic Society/European Respiratory Society International Multidisciplinary Consensus Classification of the Idiopathic Interstitial Pneumonias. American Journal of Respiratory and Critical Care Medicine 2002; 165(2): 277-304.
4. Travis WD, Hunninghake G, King TE Jr, et al. Idiopathic nonspecific interstitial pneumonia: report of an American Thoracic Society project [published correction appears in Am J Respir Crit Care Med. 2008; 178(2): 211]. Am J Respir Crit Care Med. 2008; 177(12): 1338-1347.
5. An Official American Thoracic Society/ European Respiratory Society Statement: Update of the International Multidisciplinary Classification of the Idiopathic Interstitial Pneumonias. American Journal of Respiratory and Critical Care Medicine 2013; 188(6): 733-748.
6. Wells A, Cottin V. Nonspecific interstitial pneumonia: time to be more specific? Curr Opin Pulm Med 2016; 22: 450-455.
7. Fischer A, Antoniou KM, Brown KK, et al. An official European Respiratory Society/American Thoracic Society research statement: interstitial pneumonia with autoimmune features. Eur Respir J 2015; 46: 976-987.
8. Romagnoli M, Nannini C, et al. Idiopathic nonspecific interstitial pneumonia: an interstitial lung disease associated with autoimmune disorders? European Respiratory Journal 2011; 38: 384-391.
9. Hyldgaard C, Hilberg O, et al. A cohort study of interstitial lung diseases in central Denmark. Respiratory Medicine 2014; 108: 793-799.
10. Flaherty KR, Martinez FJ, Travis W, Lynch JP 3rd. Nonspecific interstitial pneumonia (NSIP). Semin Respir Crit Care Med. 2001; 22(4): 423-434.
11. Guenther, A., Krauss, E., Tello, S. et al. The European IPF registry (eurIPFreg): baseline characteristics and survival of patients with idiopathic pulmonary fibrosis. Respir Res 2018; 19: 141.
12. Duchemann B, Annesi-Maesano I, Jacobe de Naurois C, et al. Prevalence and incidence of interstitial lung diseases in a multi-ethnic county of Greater Paris. Eur Respir J 2017; 50: 1602419.
13. Flaherty KR, Travis WD, Colby TV, et al. Histopathologic variability in usual and nonspecific interstitial pneumonias. Am J Respir Crit Care Med 2001; 164: 1722-1727.
14. Teoh A, Corte T. Nonspecific Interstitial Pneumonia. Semin Respir Crit Care Med 2020; 41: 184-201.
15. Schneider F, Hwang DM, Gibson K, Yousem SA. Nonspecific interstitial pneumonia: a study of 6 patients with progressive disease. Am J Surg Pathol 2012; 36(01): 89-93.
16. Silva CI, Müller NL, Hansell DM, Lee KS, Nicholson AG, Wells AU. Nonspecific interstitial pneumonia and idiopathic pulmonary fibrosis: changes in pattern and distribution of disease over time. Radiology 2008; 247(01): 251-259.
17. Wells AU, Kokosi M, Karagiannis K. Treatment strategies for idiopathic interstitial pneumonias. Curr Opin Pulm Med. 2014; 20(5): 442-448.
18. Li T, Guo L, Chen Z, et al. Pirfenidone in patients with rapidly progressive interstitial lung disease associated with clinically amyopathic dermatomyositis.Sci Rep 2016; 6: 33226.
19. Maher TM, Corte TJ, Fischer A, et al. Pirfenidone in patients with unclassifiable progressive fibrosing interstitial lung disease: a double-blind, randomised, placebo-controlled, phase 2 trial. Lancet Respir Med 2020; (08): 147-157.
20. Khanna D, Albera C, Fischer A, et al. An open-label, phase II study of the safety and tolerability of pirfenidone in patients with scleroderma-associated interstitial lung disease: the LOTUSS trial. J Rheumatol 2016; 43(09): 1672-1679.
21. Distler O, Highland KB, Gahlemann M, et al; SENSCIS Trial Investigators Nintedanib for systemic sclerosis-associated interstitial lung disease. N Engl J Med 2019; 380(26): 2518-2528.
22. Flaherty KR, Wells AU, Cottin V, et al; INBUILD Trial Investigators. Nintedanib in progressive fibrosing interstitial lung diseases. Engl J Med 2019; 381(18): 1718-1727.
23. Rochester CL, Fairburn C, Crouch RH. Pulmonary rehabilitation for respiratory disorders other than chronic obstructive pulmonary disease. Clin Chest Med. 2014; 35(2): 369-389.
24. Lindell KO. Nonpharmacological therapies for interstitial lung disease. Curr Pulmonol Rep 2018; 7(04): 126-132.
25. Rochester CL, Fairburn C, Crouch RH. Pulmonary rehabilitation for respiratory disorders other than chronic obstructive pulmonary disease. Clin Chest Med. 2014; 35(2): 369-389.
26. Dowman L, Hill CJ, Holland AE. Pulmonary rehabilitation for interstitial lung disease. Cochrane Database Syst Rev. 2014; (10): CD006322.
27. Crockett AJ, Cranston JM, Antic N. Domiciliary oxygen for interstitial lung disease. Cochrane Database Syst Rev. 2001;(3): CD002883.
28. Bell EC, Cox NS, Goh N, et al. Oxygen therapy for interstitial lung disease: a systematic review. Eur Respir Rev. 2017; 26(143): 160080.
29. Park IN, Kim DS, Shim TS, et al. Acute exacerbation of interstitial pneumonia other than idiopathic pulmonary fibrosis. Chest. 2007; 132(1): 214-220.
30. Collard HR, Ryerson CJ, Corte TJ, Jenkins G, Kondoh Y, Lederer DJ, et al. Acute exacerbation of idiopathic pulmonary fibrosis: an international working group report. Am J Respir Crit Care Med 2016; 194: 265-275.
31. Leuschner G, Behr J. Acute Exacerbation in Interstitial Lung Disease. Front Med (Lausanne). 2017; 4: 176.
32. Rush B, Wiskar K, Berger L, Griesdale D. The use of mechanical ventilation in patients with idiopathic pulmonary fibrosis in the United States: A nationwide retrospective cohort analysis. Respir Med. 2016; 111: 72-76.
33. Ryerson CJ, Vittinghoff E, Ley B, et al. Predicting survival across chronic interstitial lung disease: the ILD-GAP model. Chest. 2014; 145(4): 723-728.
34. Brown AW, Kaya H, Nathan SD. Lung transplantation in IIP: a review. Respirology 2016; 21(07): 1173-1184.
35. Jegal Y, Kim DS, Shim TS, et al. Physiology is a stronger predictor of survival than pathology in fibrotic interstitial pneumonia. Am J Respir Crit Care Med 2005; 171(06): 639-644.
36. Eaton T, Young P, Milne D, et al. Six-minute walk, maximal exercise tests: reproducibility in fibrotic interstitial pneumonia. Am J Respir Crit Care Med 2005; 171: 1150-7.
37. Cottin V, Nikhil A, Hirani A, et al. Presentation, diagnosis and clinical course of the spectrum of progressive-fibrosing interstitial lung diseases. European Respiratory Review 2018; 27 (150): 180076.

-
Pneumologista
Serviço de Pneumologia Departamento Coração, Vasos e Tórax Hospital de Santa Marta Centro Hospitalar Universitário Lisboa Central

As doenças pulmonares intersticiais (DPI) incluem um grande número de entidades que se caracterizam pela presença de inflamação e / ou fibrose ao nível do parênquima pulmonar e que se agrupam em dois grandes grupos: secundárias, em que existe uma causa subjacente conhecida, ou pneumonias intersticiais idiopáticas (PII), em que não é possível determinar uma causa específica.
A sua classificação implica, na maioria dos casos, uma abordagem multidisciplinar que inclua, no mínimo, a opinião de um pneumologista, de um radiologista e de um patologista com experiência na área.
No entanto, e apesar desta abordagem multidisciplinar, existe um grupo de doentes a quem não é possível atribuir, com certeza, um diagnóstico preciso. Nesse sentido, no consenso de 2002 da ATS / ERS1 foi pela primeira vez referida a necessidade de considerar a existência de uma entidade denominada de Pneumonia Intersticial Idiopática Inclassificável (inPII), embora só no consenso de 20132 esta entidade fosse considerada como um diagnóstico per se.
De realçar que, apesar do foco recente nesta entidade, são ainda várias as lacunas no conhecimento da fisiopatologia da doença e consequentemente da melhor abordagem diagnóstica, terapêutica e de follow-up.
De acordo com o consenso de 2002 da ATS / ERS define-se como pneumonia intersticial idiopática inclassificável (inPII) uma pneumonia intersticial idiopática que, apesar de uma extensa avaliação multidisciplinar (clínica, radiológica e histológica), não se consegue enquadrar em nenhuma outra categoria.
Esta incapacidade de classificação pode resultar de diversos factores:
a) Impossibilidade de obter informação
essencial para prosseguir avaliação (ex.
ausência de condições para biópsia pulmonar, material da
biópsia insuficiente
para diagnóstico ou recusa por parte do doente);
b) Discrepâncias major entre os dados
clínicos, radiológicos e histológicos;
c) Terapêuticas prévias que
alteram/dificultam a interpretação dos achados
radiológicos ou histológicos;
d) Discrepância nos achados
histológicos em diferentes amostras, que não
consegue ser resolvida após integração com os dados
clínicos e radiológicos.
É importante ressalvar que todas estas situações devem
ser abordadas de
forma multidisciplinar e devem ser envidados todos os
esforços para tentar
identificar um diagnóstico.
Paralelamente, alguns autores propuseram dividir esta categoria em dois grupos:3
• um grupo em que foi obtida informação histológica
adequada e de qualidade
aceitável, que denominam de inclassificável;
• um segundo grupo em que não foi obtida biópsia ou o
material da mesma não
foi suficiente para uma análise satisfatória, que
denominam de não classificado.
Mais recentemente foi proposto um algoritmo diagnóstico, no qual, após integração da informação clínica, laboratorial (incluído estudo marcadores serológicos de autoimunidade), radiológica e histológica, se atribui um grau de probabilidade / confiança ao diagnóstico, denominando-se de inclassificável as situações em que o grau de confiança no diagnóstico é inferior a 50%.4
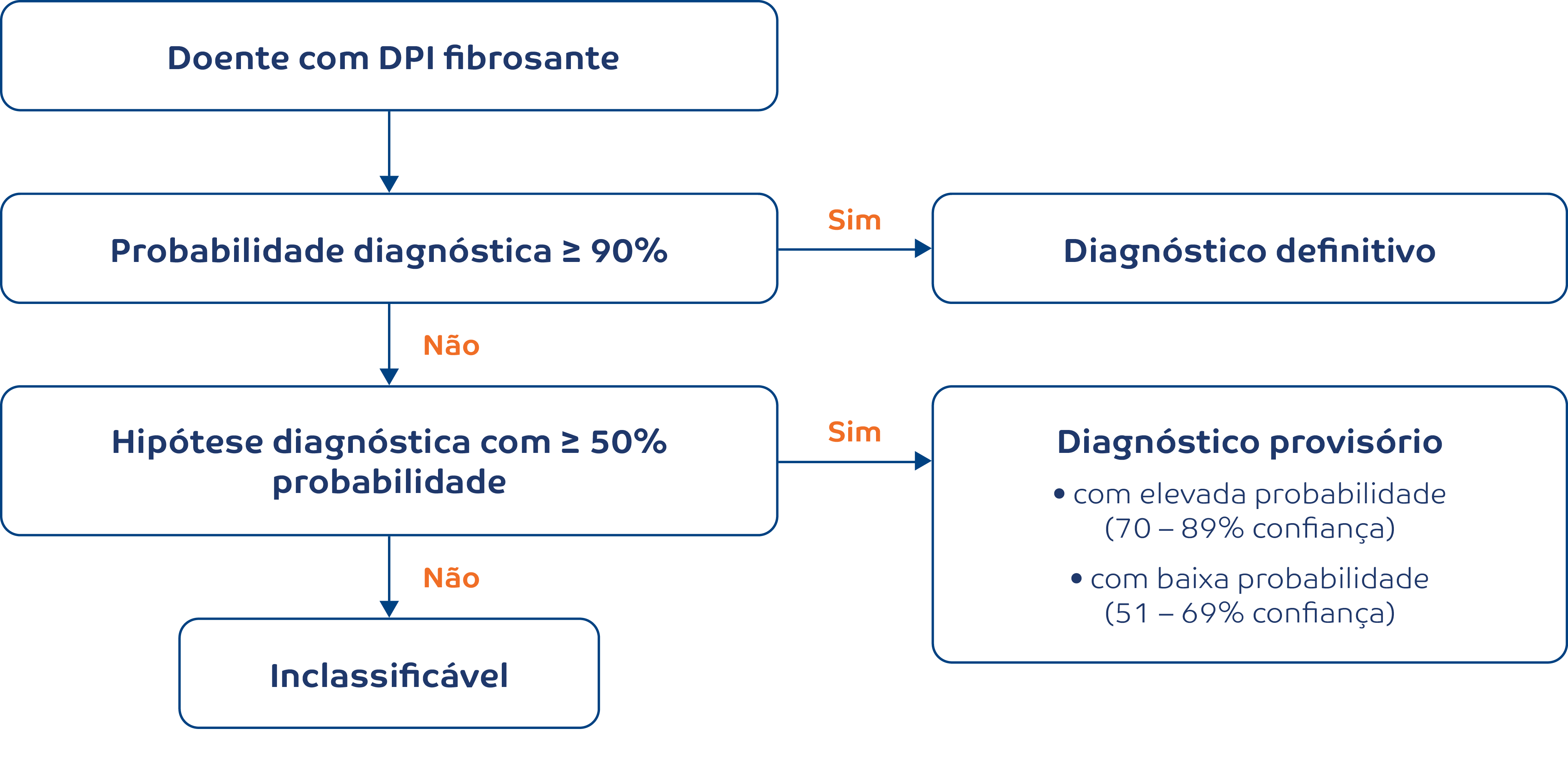
Figura 1: Proposta de classificação com base na probabilidade diagnóstica (adaptado de 4).
Nos diferentes estudos de coorte publicados, a percentagem de doentes com inPII ronda os 10-15%.3,5,6,7 No entanto estes estudos diferem no desenho e na definição utilizada, sendo que em alguns deles apenas foram considerados doentes submetidos a biópsia pulmonar.
Apesar disso, ao analisar apenas os doentes com avaliação histológica aceitável, considerados por alguns autores como os verdadeiros “inclassificáveis”, a percentagem de inPII é sobreponível, reforçando a ideia de que, mesmo nos casos em que a marcha diagnóstica é completa, a incapacidade de atribuir um diagnóstico preciso se mantém numa proporção considerável de doentes.
Os doentes com pneumonia intersticial idiopática inclassificável constituem um grupo heterogéneo de doentes com características típicas das doenças intersticiais fibrosantes.
Clinicamente apresentam frequentemente um quadro subagudo caracterizado por dispneia de agravamento progressivo, tosse seca e crepitações na auscultação pulmonar.
Na maioria das séries publicadas a idade dos doentes, prevalência de sexo masculino e história de exposição a tabaco é habitualmente intermédia em relação à descrita para a Fibrose Pulmonar Idiopática (FPI) e para as outras pneumonias intersticiais fibrosantes.3,5,6,7
Na avaliação funcional respiratória estes doentes apresentam tipicamente uma alteração ventilatória restritiva com compromisso das trocas gasosas, sendo que nalgumas das séries publicadas os valores de FVC e DLCO estão mais preservados que nos doentes com FPI.
Na TC de alta resolução, os padrões radiológicos observados são, por ordem crescente de frequência, de pneumonia intersticial usual (UIP), UIP possível e inconsistente com UIP.5,7
As opções terapêuticas destes doentes incluem, como habitual, um componente farmacológico e um componente não farmacológico. Em relação ao tratamento farmacológico não existem muitos estudos que visem especificamente esta população, pelo que as opções terapêuticas devem ser definidas caso a caso. A abordagem mais utilizada tem sido definir, em reunião multidisciplinar, quais os principais diagnósticos diferenciais e, dentro destes, qual o diagnóstico mais provável, prosseguindo para o tratamento farmacológico mais adequado para esse diagnóstico. Neste tipo de abordagem, o passo essencial é definir se o diagnóstico mais provável é ou não Fibrose Pulmonar Idiopática.
Em alternativa, alguns autores propõem uma abordagem mais abrangente, focada no comportamento da doença, que se encontra resumida na figura 2.4
Em relação ao tratamento não farmacológico, tal como a todos os doentes com patologia intersticial, também a estes doentes se recomenda cessação tabágica, vacinação antipneumocócica e antigripal, reabilitação respiratória, tratamento das comorbilidades e, quando indicado, oxigenoterapia de longa duração e transplantação pulmonar.
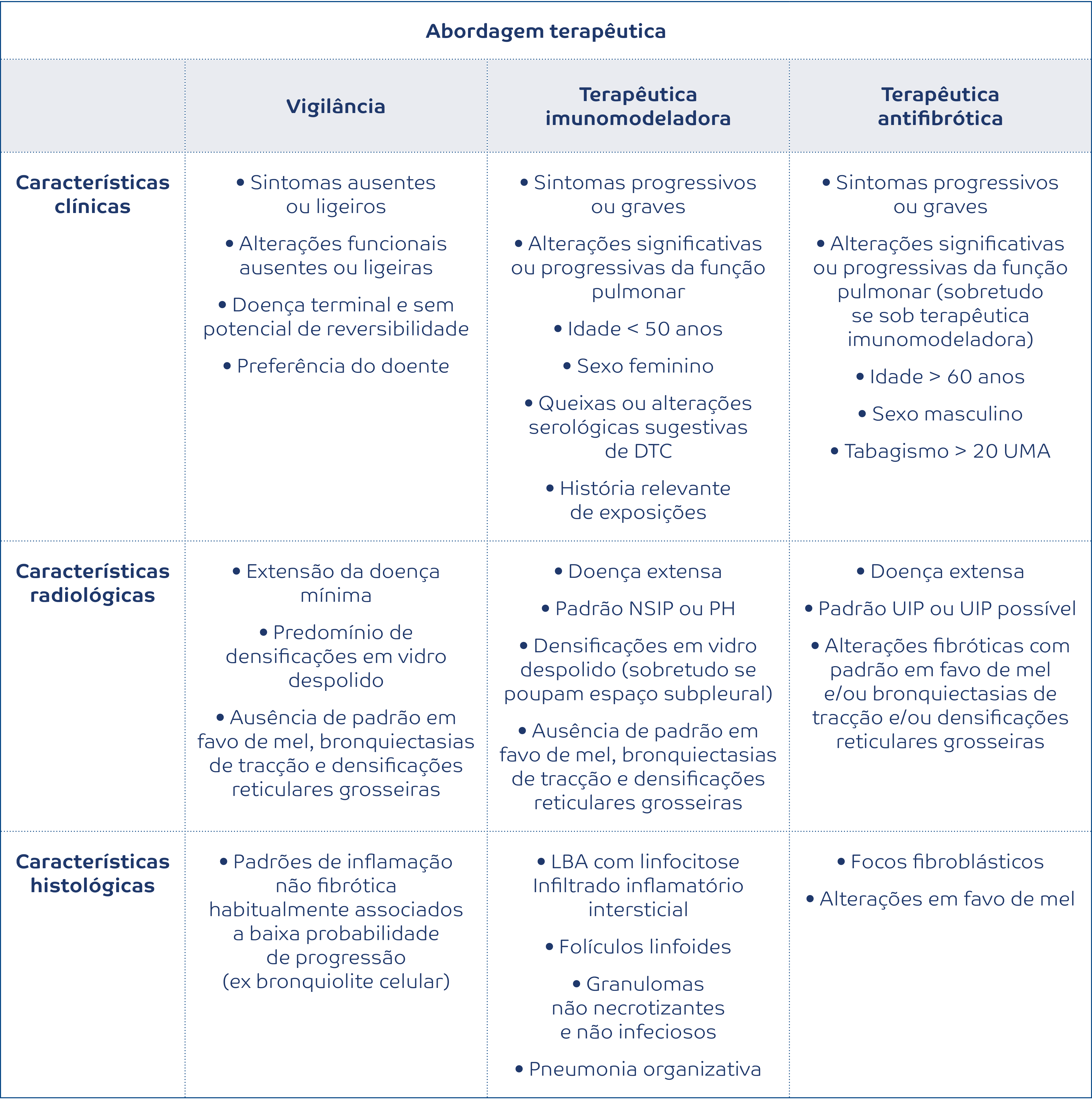
Figura 2: Proposta de abordagem terapêutica na Pneumonia Intersticial Inclassificável (adaptado de 4).
DTC: doença do tecido conjuntivo; LBA: lavado broncoalveolar; NSIP: pneumonia intersticial não específica; PH: pneumonite de hipersensibilidade; UIP: pneumonia intersticial usual, UMA: Unidade-maço / ano.
Extrapolando os critérios propostos por Collard e colaboradores em 2016 para as exacerbações da FPI8, podemos definir como exacerbação da inPII um agravamento clínico, nomeadamente da dispneia, com menos de um mês de evolução, associado ao aparecimento de opacidades em vidro despolido e/ ou consolidações de novo na TC torácica, não explicável por outras situações (nomeadamente insuficiência cardíaca ou sobrecarga hídrica).
Os principais factores de risco para exacerbação são: necessidade de oxigenoterapia de longa duração (OLD), valores baixos de FVC e DLCO ao diagnóstico e queda recente da FVC ≥ 10% e/ou da DLCO ≥ 15%. Apesar do previsível impacto das exacerbações no prognóstico destes doentes, os estudos publicados sobre esta temática são escassos e limitados a análises retrospectivas.
De acordo com um dos estudos mais recentes9 a incidência anual e frequência das exacerbações é superior à dos doentes com FPI (10.29%/ano vs 5.85%/ ano) sendo que também ocorrem mais precocemente após o diagnóstico (14,5 vs 74,5 meses).
Comparativamente aos doentes com exacerbação de FPI, os doentes com inPII têm idade superior, são em maior percentagem do sexo feminino e não fumadores, tem FVC mais preservada e menos fibrose na TC.
No entanto, a sobrevida aos 12 meses dos dois grupos é similar (54.2% vs 51%). Nesse mesmo estudo, a análise de diferentes variáveis clínicas, funcionais e radiológicas permitiu determinar uma associação entre o prognóstico e as seguintes variáveis: % FVC nos 12 meses prévios à exacerbação; índice GAP nos 12 meses prévios à exacerbação; extensão das alterações fibróticas na TC nos 12 meses prévios à exacerbação e necessidade de OLD prévia à exacerbação.
A introdução do conceito de um fenótipo fibrosante progressivo, comum às diferentes DPIs, representou uma alteração no paradigma na abordagem destas doenças.
Os doentes com este fenótipo apresentam um declínio clínico e funcional progressivo sob terapêutica, e estima-se que representem cerca de 20-30% dos doentes com DPI.10 Apesar da sua importância, ainda não existe uma definição consensual para este fenótipo, sendo habitualmente utilizada uma combinação de critérios clínicos, funcionais e imagiológicos.
Recentemente foram publicados resultados de ensaios clínicos que visavam esta população de doentes em particular e cujos critérios de seleção (e de definição de progressão) contribuíram para uma abordagem mais consensual. Assim, de uma forma geral, são aceites como critérios de progressão uma queda ≥ 10% da FVC ou uma queda de 5-10% da FVC associada a um agravamento clínico ou radiológico.
Num estudo de Ryerson e colaboradores5, que procurou avaliar a prevalência, características e evolução dos doentes com inPII e comparar com outras DPIs, constatou-se que 52% dos doentes com inPII apresentaram progressão nos primeiros 12 meses de seguimento vs. 63% dos doentes com FPI e 45% dos doentes com outras DPIs fibróticas.
Os factores preditores de progressão da doença encontrados foram: história de tabagismo; % FVC ao diagnóstico, DLCO ≤ 55% ao diagnóstico; predominância de alterações fibróticas e/ou presença de favo de mel na TC e padrão UIP ou UIP possível na TC.
Nos últimos anos foram publicados diversos estudos que pretenderam clarificar a evolução e prognóstico associado à inPII.5,7,11 De acordo com os resultados obtidos, os doentes com inPII apresentam um prognóstico intermédio entre FPI e as outras DPIs. Nos diferentes estudos analisados, a sobrevida média varia entre os 5 e os 7 anos, significativamente melhor que a sobrevida média esperada para os doentes com FPI, que não ultrapassa os 5,2 anos.
No sentido de melhor caracterizar a esta doença e apoiar decisões clínicas futuras, foram analisados diversos parâmetros clínicos, funcionais e radiológicos, visando clarificar quais deles estariam associados à evolução e prognóstico destes doentes.
De uma forma global os principais factores de prognóstico
encontrados
foram:
• Parâmetros clínicos: tabagismo,
necessidade de OLD e a pontuação no índice de GAP;
• Parâmetros funcionais: % FVC ao
diagnóstico, queda anual da FVC igual ou
superior a 10% e DLCO igual ou inferior a 55% ao
diagnóstico;
• Parâmetros radiológicos: predominância de
alterações fibróticas e/ou
presença de padrão em favo de mel na TC, padrão UIP ou UIP
possível na TCAR.
1. American Thoracic Society; European Respiratory Society. American Thoracic Society/European Respiratory Society International Multidisciplinary Consensus Classification of the Idiopathic Interstitial Pneumonias. This joint statement of the American Thoracic Society (ATS), and the European Respiratory Society (ERS) was adopted by the ATS board of directors, June 2001 and by the ERS Executive Committee, June 2001. Am J Respir Crit Care Med. 2002 Jan 15;165(2):277-304.
2. Travis WD, Costabel U, Hansell DM, King TE Jr, Lynch DA, Nicholson AG, Ryerson CJ, Ryu JH, Selman M, Wells AU, Behr J, Bouros D, Brown KK, Colby TV, Collard HR, Cordeiro CR, Cottin V, Crestani B, Drent M, Dudden RF, Egan J, Flaherty K, Hogaboam C, Inoue Y, Johkoh T, Kim DS, Kitaichi M, Loyd J, Martinez FJ, Myers J, Protzko S, Raghu G, Richeldi L, Sverzellati N, Swigris J, Valeyre D; ATS/ERS Committee on Idiopathic Interstitial Pneumonias. An official American Thoracic Society/European Respiratory Society statement: Update of the international multidisciplinary classification of the idiopathic interstitial pneumonias. Am J Respir Crit Care Med. 2013 Sep 15;188(6):733-48.
3. Skolnik K, Ryerson CJ. Unclassifiable interstitial lung disease: A review. Respirology. 2016 Jan;21(1):51-6.
4. Ryerson CJ, Corte TJ, Myers JL, Walsh SLF, Guler SA. A contemporary practical approach to the multidisciplinary management of unclassifiable interstitial lung disease. Eur Respir J. 2021 Dec 16;58(6):2100276.
5. Ryerson CJ, Urbania TH, Richeldi L, Mooney JJ, Lee JS, Jones KD, Elicker BM, Koth LL, King TE Jr, Wolters PJ, Collard HR. Prevalence and prognosis of unclassifiable interstitial lung disease. Eur Respir J. 2013 Sep;42(3):750-7.
6. Traila D, Oancea C, Tudorache E, Mladinescu OF, Timar B, Tudorache V. Clinical profile of unclassifiable interstitial lung disease: Comparison with chronic fibrosing idiopathic interstitial pneumonias. J Int Med Res. 2018 Jan;46(1):448- 456.
7. Krauss E, El-Guelai M, Pons-Kuehnemann J, Dartsch RC, Tello S, Korfei M, Mahavadi P, Breithecker A, Fink L, Stoehr M, Majeed RW, Seeger W, Crestani B, Guenther A. Clinical and Functional Characteristics of Patients with Unclassifiable Interstitial Lung Disease (uILD): Long-Term FollowUp Data from European IPF Registry (eurIPFreg). J Clin Med. 2020 Aug 3;9(8):2499.
8. Collard HR, Ryerson CJ, Corte TJ, Jenkins G, Kondoh Y, Lederer DJ, Lee JS, Maher TM, Wells AU, Antoniou KM, Behr J, Brown KK, Cottin V, Flaherty KR, Fukuoka J, Hansell DM, Johkoh T, Kaminski N, Kim DS, Kolb M, Lynch DA, Myers JL, Raghu G, Richeldi L, Taniguchi H, Martinez FJ. Acute Exacerbation of Idiopathic Pulmonary Fibrosis. An International Working Group Report. Am J Respir Crit Care Med. 2016 Aug 1;194(3):265-75.
9. Enomoto N, Naoi H, Aono Y, Katsumata M, Horiike Y, Yasui H, Karayama M, Hozumi H, Suzuki Y, Furuhashi K, Fujisawa T, Inui N, Nakamura Y, Suda T. Acute exacerbation of unclassifiable idiopathic interstitial pneumonia: comparison with idiopathic pulmonary fibrosis. Ther Adv Respir Dis. 2020 Jan- Dec;14:1-12.
10. Wong AW, Ryerson CJ, Guler SA. Progression of fibrosing interstitial lung disease. Respir Res. 2020 Jan 29;21(1):32.
11. Hyldgaard C, Bendstrup E, Wells AU, Hilberg O. Unclassifiable interstitial lung diseases: Clinical characteristics and survival. Respirology. 2017 Apr;22(3):494-500.






















